Διαφορά μεταξύ χλωροβενζολίου και χλωριούχου βενζυλίου
Κύρια διαφορά – Χλωροβενζόλιο έναντι χλωριούχου βενζυλίου
Αν και τα ονόματα Χλωροβενζόλιο και βενζυλοχλωρίδιο προκαλούν σύγχυση, είναι δύο όροι που χρησιμοποιούνται για την ονομασία δύο διαφορετικών ενώσεων. Και οι δύο είναι αρωματικές ενώσεις επειδή περιέχουν δακτυλίους βενζολίου υποκατεστημένα με διαφορετικούς υποκαταστάτες. Έχουν διαφορετικές χημικές και φυσικές ιδιότητες όπως συζητείται παρακάτω. Η κύρια διαφορά μεταξύ του χλωροβενζολίου και του χλωριούχου βενζολίου είναι ότι το χλωροβενζόλιο έχει ένα άτομο χλωρίου άμεσα συνδεδεμένο με τον δακτύλιο βενζολίου, ενώ το χλωριούχο βενζύλιο έχει ένα άτομο χλωρίου έμμεσα συνδεδεμένο με τον δακτύλιο βενζολίου (συνδεδεμένο μέσω μιας ομάδας -CH2).
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Χλωροβενζόλιο
– Ορισμός, Χημικές ιδιότητες, Χρήσεις
2. Τι είναι το χλωριούχο βενζύλιο
– Ορισμός, Χημικές ιδιότητες, Χρήσεις
3. Ποια είναι η διαφορά μεταξύ χλωροβενζολίου και χλωριούχου βενζυλίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αρωματικό, βενζόλιο, χλωριούχο βενζύλιο, σημείο βρασμού, χλωροβενζόλιο, χλωρομεθυλοβενζόλιο, σημείο τήξης, μοριακή μάζα

Τι είναι το Chlorobenzene
Το χλωροβενζόλιο είναι μια οργανική ένωση με τον χημικό τύπο C6 H5 Cl. Προέρχεται από έναν δακτύλιο βενζολίου με την αντικατάσταση ενός ατόμου υδρογόνου με ένα άτομο χλωρίου. Είναι μια αρωματική ένωση. Σε θερμοκρασία δωματίου, το χλωροβενζόλιο είναι ένα άχρωμο, εύφλεκτο υγρό. Η κοινή ονομασία που χρησιμοποιείται για το χλωροβενζόλιο είναι χλωριούχο βενζόλιο.
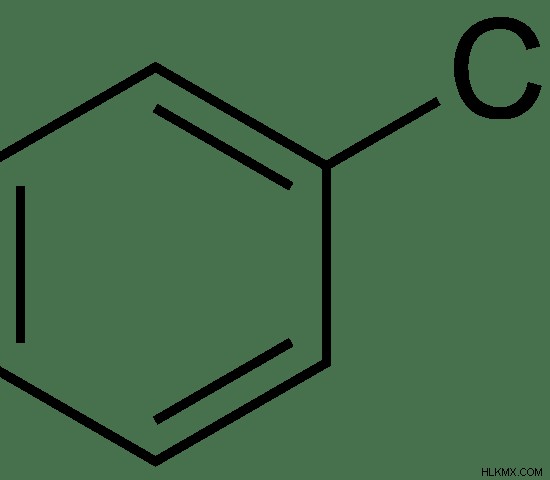
Εικόνα 1:Χημική δομή του χλωροβενζολίου
Η μοριακή μάζα του χλωροβενζολίου είναι 112,56 g/mol. Έχει μια μυρωδιά σαν αμύγδαλο. Το σημείο τήξης του χλωροβενζολίου είναι −45°C και το σημείο βρασμού είναι 131°C. Αυτή η ένωση είναι διαλυτή στους περισσότερους οργανικούς διαλύτες. Αλλά είναι αδιάλυτο στο νερό. Οι ατμοί του χλωροβενζολίου είναι βαρύτεροι από τον κανονικό αέρα.
Το χλωροβενζόλιο χρησιμοποιείται ως ενδιάμεσο στην παραγωγή ζιζανιοκτόνων, φυτοφαρμάκων, καουτσούκ κ.λπ. Χρησιμοποιείται επίσης ως διαλύτης υψηλής βρασμού σε διάφορες βιομηχανίες λόγω του υψηλού σημείου βρασμού. Ωστόσο, το χλωροβενζόλιο παρουσιάζει χαμηλή έως μέτρια τοξικότητα.
Τι είναι το Benzyl Chloride
Το βενζυλοχλωρίδιο είναι μια αρωματική οργανική ένωση με τον χημικό τύπο C7 H7 Cl. Προέρχεται από ένα τολουόλιο με την αντικατάσταση ενός ατόμου υδρογόνου μιας ομάδας μεθυλίου με ένα άτομο χλωρίου. Σε θερμοκρασία δωματίου, είναι ένα άχρωμο (ελαφρώς κίτρινο) υγρό με πικάντικη οσμή. Ονομάζεται βενζυλοχλωρίδιο λόγω της παρουσίας μιας βενζυλομάδας.
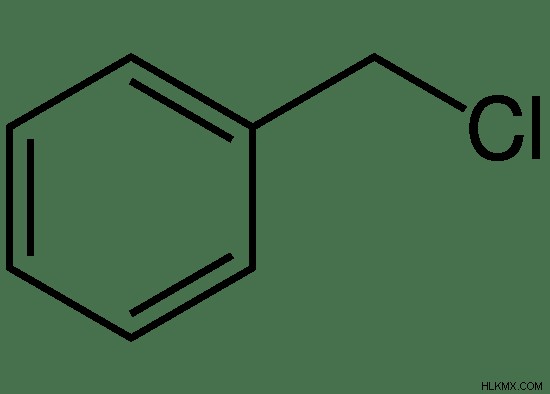
Εικόνα 2:Χημική δομή του χλωριούχου βενζυλίου
Η μοριακή μάζα του βενζυλοχλωριδίου είναι 126,58 g/mol. Το σημείο τήξης του βενζυλοχλωριδίου είναι −39 °C και το σημείο βρασμού είναι 179 °C. Είναι πολύ ελαφρώς διαλυτό στο νερό αλλά είναι καλά διαλυμένο σε οργανικούς διαλύτες. Το όνομα IUPAC του βενζυλοχλωριδίου είναι χλωρομεθυλοβενζόλιο .
Το βενζυλοχλωρίδιο παράγεται κυρίως από τη φωτοχημική αντίδραση μεταξύ τολουολίου και αερίου χλωρίου. Εδώ, το HCl σχηματίζεται ως υποπροϊόν. Η αντίδραση είναι μια διαδικασία ελεύθερων ριζών. Το χλωριούχο βενζύλιο είναι πρόδρομος για την παραγωγή βενζυλεστέρων και βενζυλαιθέρων. Επιπλέον, αυτή η ένωση μπορεί να χρησιμοποιηθεί για την παρασκευή αντιδραστηρίου Grignard με αντίδραση μεταξύ βενζυλοχλωριδίου και μεταλλικού μαγνησίου.
Διαφορά μεταξύ χλωροβενζολίου και χλωριούχου βενζυλίου
Ορισμός
Χλωροβενζόλιο: Το χλωροβενζόλιο είναι μια οργανική ένωση που έχει τον χημικό τύπο C6 H5 Cl.
Βενζυλοχλωρίδιο: Το βενζυλοχλωρίδιο είναι μια αρωματική οργανική ένωση με χημικό τύπο C7 H7 Cl.
Θέση του ατόμου χλωρίου
Χλωροβενζόλιο: Το χλωροβενζόλιο έχει ένα άτομο χλωρίου άμεσα συνδεδεμένο με τον δακτύλιο βενζολίου.
Βενζυλοχλωρίδιο: Το χλωριούχο βενζύλιο έχει ένα άτομο χλωρίου έμμεσα συνδεδεμένο με τον δακτύλιο βενζολίου (προσκολλημένο μέσω μιας ομάδας -CH2).
Μοριακή μάζα
Χλωροβενζόλιο: Η μοριακή μάζα του χλωροβενζολίου είναι 112,56 g/mol.
Βενζυλοχλωρίδιο: Η μοριακή μάζα του βενζυλοχλωριδίου είναι 126,58 g/mol.
Σημείο τήξης και βρασμού
Χλωροβενζόλιο: Το σημείο τήξης του χλωροβενζολίου είναι −45 °C και το σημείο βρασμού είναι 131 °C.
Βενζυλοχλωρίδιο: Το σημείο τήξης του βενζυλοχλωριδίου είναι −39 °C και το σημείο βρασμού είναι 179 °C.
Οσμή
Χλωροβενζόλιο: Το χλωροβενζόλιο έχει μια μυρωδιά που μοιάζει με αμύγδαλο.
Βενζυλοχλωρίδιο: Το χλωριούχο βενζύλιο έχει έντονη οσμή.
Διαλυτότητα στο νερό
Χλωροβενζόλιο: Το χλωροβενζόλιο δεν είναι υδατοδιαλυτό.
Βενζυλοχλωρίδιο: Το χλωριούχο βενζύλιο είναι πολύ ελαφρώς υδατοδιαλυτό.
Συμπέρασμα
Το χλωροβενζόλιο και το βενζυλοχλωρίδιο είναι δύο αρωματικές οργανικές ενώσεις που περιέχουν δακτυλίους βενζολίου στη χημική τους δομή. Η κύρια διαφορά μεταξύ του χλωροβενζολίου και του χλωριούχου βενζολίου είναι ότι το χλωροβενζόλιο έχει ένα άτομο χλωρίου άμεσα συνδεδεμένο με τον δακτύλιο βενζολίου, ενώ το βενζυλοχλωρίδιο έχει ένα άτομο χλωρίου έμμεσα συνδεδεμένο με τον δακτύλιο βενζολίου (προσαρτημένο μέσω μιας ομάδας -CH2).
Αναφορά:
1. «ΧΛΩΡΟΒΕΝΖΟΛΙΟ». Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, Εθνική Βιβλιοθήκη Ιατρικής των ΗΠΑ, Διατίθεται εδώ.
2. «Βενζυλοχλωρίδιο». Wikipedia, Ίδρυμα Wikimedia, 5 Ιανουαρίου 2018, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Chlorobenzene 200» του Emeldir (συζήτηση) – Δική του εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "Benzyl chloride" Από Χρήστη:Bryan Derksen – Ίδιο έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia