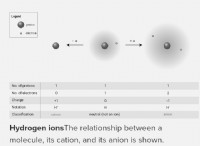
Πώς λέτε τον αριθμό χρέωσης ή οξείδωσης ενός στοιχείου;
Κατανόηση των βασικών
* χρέωση: Αναφέρεται στο ηλεκτρικό φορτίο που μεταφέρει ένα άτομο ή ιόν. Μπορεί να είναι θετικό (κατιόν) ή αρνητικό (ανιόν).
* Αριθμός οξείδωσης: Αντιπροσωπεύει την υποθετική φόρτιση που θα είχε ένα άτομο εάν όλοι οι δεσμοί του ήταν 100% ιοντικοί. Μας βοηθά να παρακολουθούμε τη μεταφορά ηλεκτρονίων σε χημικές αντιδράσεις.
Βασικοί κανόνες και στρατηγικές
1. Στοιχειώδης κατάσταση: Τα στοιχεία στην καθαρή, μη συμβατική μορφή τους έχουν αριθμό οξείδωσης 0. (Παράδειγμα:Na, O2, Fe)
2. μονοτομικά ιόντα: Ο αριθμός οξείδωσης ενός μονατομικού ιόντος ισούται με την επιβάρυνση του. (Παράδειγμα:Το Na + έχει αριθμό οξείδωσης +1, O2- έχει αριθμό οξείδωσης -2)
3. Ομάδα 1 και 2 Στοιχεία: Τα στοιχεία της ομάδας 1 (αλκαλικά μέταλλα) έχουν πάντα έναν αριθμό οξείδωσης +1 και τα στοιχεία της ομάδας 2 (μέταλλα αλκαλικής γης) έχουν πάντα έναν αριθμό οξείδωσης +2.
4. Ομάδα 17 Στοιχεία (Halogens): Τα αλογόνα έχουν συνήθως έναν αριθμό οξείδωσης, εκτός από το πότε συνδυάζονται με οξυγόνο ή άλλο αλογόνο που είναι πιο ηλεκτροαρνητικό.
5. Υδρογόνο: Συνήθως έχει αριθμό οξείδωσης +1, εκτός από μεταλλικά υδρίδια όπου έχει αριθμό οξείδωσης -1.
6. οξυγόνο: Συνήθως έχει αριθμό οξείδωσης, εκτός από υπεροξείδια (όπως H2O2) όπου έχει αριθμό οξείδωσης -1 και σε ενώσεις με φθορίνη όπου έχει θετικό αριθμό οξείδωσης.
7. άθροισμα των αριθμών οξείδωσης: Το άθροισμα των αριθμών οξείδωσης σε μια ουδέτερη ένωση είναι πάντα μηδέν. Σε ένα πολυατομικό ιόν, το άθροισμα ισούται με την επιβάρυνση του ιόντος.
8. Το στοιχείο με υψηλότερη ηλεκτροαρνητικότητα σε έναν δεσμό αποδίδεται αρνητικός αριθμός οξείδωσης.
Παράδειγμα:
Ας προσδιορίσουμε τον αριθμό οξείδωσης θείου στο θειικό οξύ (H2SO4):
* υδρογόνο (h): +1 (κανόνας 5)
* οξυγόνο (o): -2 (κανόνας 6)
* ας είναι ο αριθμός οξείδωσης του θείου.
* 2 (+1) + x + 4 (-2) =0 (άθροισμα αριθμών οξείδωσης σε ουδέτερη ένωση είναι μηδέν)
* 2 + x - 8 =0
* x =+6
Επομένως, ο αριθμός οξείδωσης θείου σε θειικό οξύ είναι +6.
Σημαντική σημείωση:
* Ορισμένα στοιχεία μπορούν να έχουν πολλαπλούς αριθμούς οξείδωσης ανάλογα με την ένωση που βρίσκονται.
* Μπορεί να χρειαστεί να χρησιμοποιήσετε τις γνώσεις σας σχετικά με τη χημική σύνδεση, την ηλεκτροαρνητικότητα και άλλους κανόνες για να προσδιορίσετε τον σωστό αριθμό οξείδωσης σε συγκεκριμένες περιπτώσεις.
Επιτρέψτε μου να ξέρω αν θέλετε να εξασκηθείτε με περισσότερα παραδείγματα!