Ιόν
Ο πυρήνας ενός ατόμου αποτελείται από θετικά φορτισμένα πρωτόνια και ουδέτερα νετρόνια και περιβάλλεται από ένα νέφος αρνητικά φορτισμένων ηλεκτρονίων. Τα ηλεκτρονικά ουδέτερα άτομα έχουν τον ίδιο αριθμό πρωτονίων και ηλεκτρονίων. Το άτομο έχει καθαρό ηλεκτρικό φορτίο εάν ο συνολικός αριθμός των ηλεκτρονίων δεν είναι ίσος με τον συνολικό αριθμό των πρωτονίων.
Ιόν είναι κάθε άτομο ή μόριο που έχει καθαρό φορτίο, είτε θετικό είτε αρνητικό. Ένα μονοατομικό ιόν αποτελείται από ένα μόνο άτομο. ένα πολυατομικό ιόν αποτελείται από δύο ή περισσότερα άτομα. Επειδή το θετικό ηλεκτρικό φορτίο ενός πρωτονίου είναι ίσο με το αρνητικό φορτίο ενός ηλεκτρονίου, το καθαρό ηλεκτρικό φορτίο ενός ιόντος είναι ίσο με τον αριθμό των πρωτονίων του μείον τον αριθμό των ηλεκτρονίων του.
Τα ιόντα είναι εξαιρετικά αντιδραστικά μόρια. Βρίσκονται κυρίως σε αέρια κατάσταση και δεν είναι άφθονα στη Γη. Όταν τα άλατα αλληλεπιδρούν με τους διαλύτες τους σε υγρή ή στερεή κατάσταση, παράγονται ιόντα. Όπως τα ηλεκτρικά φορτία τα απωθούν, ενώ τα αντίθετα φορτία τα προσελκύουν.
Τύπος ιόντων
Τα ιόντα διατίθενται σε διάφορα σχήματα και μεγέθη. Τα ανιόντα έχουν καθαρό αρνητικό φορτίο επειδή έχουν περισσότερα ηλεκτρόνια από πρωτόνια. Τα κατιόντα έχουν καθαρό θετικό φορτίο επειδή έχουν περισσότερα πρωτόνια από ηλεκτρόνια. Τα αμφιτεριόντα είναι ουδέτερα μόρια που έχουν θετικά και αρνητικά φορτία σε διαφορετικά σημεία. Επειδή τα πλεονάζοντα ηλεκτρόνια αντιστέκονται το ένα στο άλλο και προστίθενται στο φυσικό μέγεθος του νέφους ηλεκτρονίων, τα ανιόντα είναι συχνά μεγαλύτερα από το μητρικό μόριο ή άτομο. Λόγω του μειωμένου μεγέθους των νεφών ηλεκτρονίων τους, τα κατιόντα είναι συχνά μικρότερα από τα μητρικά άτομα ή μόριά τους.
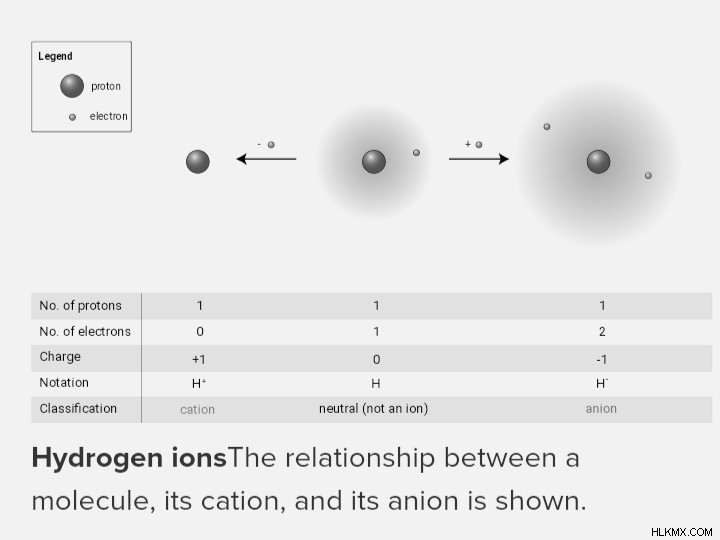
Αυτό το διάγραμμα απεικονίζει την αλληλεπίδραση μεταξύ ενός μορίου, του κατιόντος και του ανιόντος του.
Το καθαρό αρνητικό φορτίο ενός ιόντος γράφεται σε εκθέτη αμέσως μετά τη χημική δομή του ατόμου/μορίου. Το μέγεθος των μεμονωμένα φορτισμένων μορίων/ατόμων γενικά παραλείπεται όταν το καθαρό φορτίο γράφεται με το μέγεθος πριν από το πρόσημο. Οι ρωμαϊκοί αριθμοί χρησιμοποιούνται μερικές φορές για να αναπαραστήσουν μονοατομικά ιόντα, με τους υπερκείμενους αριθμούς να δηλώνουν το καθαρό φορτίο και την επίσημη κατάσταση οξείδωσης του στοιχείου. Το Fe2+, για παράδειγμα, μπορεί να αναφέρεται ως Fe (II). Για τα μονοατομικά ιόντα, αυτές οι αναπαραστάσεις είναι ισοδύναμες. Ωστόσο, οι ρωμαϊκοί αριθμοί δεν μπορούν να χρησιμοποιηθούν για πολυατομικά ιόντα.
Σχηματισμός ιόντων
Ιοντισμός είναι η διαδικασία κατά την οποία ένα ουδέτερο άτομο χάνει ή αποκτά ηλεκτρόνια, με αποτέλεσμα το σχηματισμό ιόντων. Τα ηλεκτρόνια του εξωτερικού κελύφους είναι πιο στενά συνδεδεμένα με τον θετικά φορτισμένο πυρήνα και επομένως δεν συμμετέχουν σε αυτόν τον τύπο χημικής αλληλεπίδρασης. τα ηλεκτρόνια του εσωτερικού κελύφους είναι πιο στενά συνδεδεμένα με τον θετικά φορτισμένο πυρήνα και επομένως δεν συμμετέχουν σε αυτόν τον τύπο χημικής αλληλεπίδρασης.
Ιονισμός είναι η διαδικασία ανταλλαγής ηλεκτρονίων μεταξύ ατόμων ή μορίων. Η διαδικασία υποκινείται από την επιθυμία να επιτευχθούν πιο σταθερές ηλεκτρονικές διαμορφώσεις, όπως ο κανόνας της οκτάδας, ο οποίος δηλώνει ότι το εξωτερικό κέλυφος (σθένους) των περισσότερων σταθερών ατόμων και ιόντων έχει οκτώ ηλεκτρόνια. Πολυατομικά και μοριακά ιόντα μπορούν επίσης να σχηματιστούν κερδίζοντας ή χάνοντας στοιχειακά ιόντα σε ουδέτερα μόρια, όπως το Η+. Τα πολυατομικά ιόντα είναι διαβόητα ότι είναι εξαιρετικά ασταθή και αντιδραστικά.
Το Na+ είναι ένα συνηθισμένο παράδειγμα ιόντος. Επειδή το νάτριο έχει έντεκα ηλεκτρόνια, έχει θετικό φορτίο. Το νάτριο, από την άλλη πλευρά, θα ήταν πιο σταθερό με 10 ηλεκτρόνια, σύμφωνα με τον κανόνα της οκτάδας (2 στο εσωτερικό του κέλυφος, 8 στο εξωτερικό του κέλυφος). Ως αποτέλεσμα, το νάτριο χάνει ένα ηλεκτρόνιο για να γίνει πιο σταθερό. Το χλώριο, από την άλλη πλευρά, τείνει να αποκτά ένα ηλεκτρόνιο και να σχηματίζει Cl–. Το χλώριο έχει 17 ηλεκτρόνια από τη φύση του, ωστόσο θα ήταν πιο σταθερό αν είχε 18 ηλεκτρόνια (2 στο πιο εσωτερικό του φλοιό, 8 στο δεύτερο κέλυφος του και 8 στο κέλυφος σθένους). Ως αποτέλεσμα, το χλώριο θα αποκτήσει αρνητικό φορτίο κλέβοντας ένα ηλεκτρόνιο από άλλο άτομο.
Συμπέρασμα
Συμπεραίνουμε ότι, όταν η ποσότητα των πρωτονίων σε ένα άτομο δεν είναι ίση με τον αριθμό των ηλεκτρονίων, προκύπτουν ιόντα. Εάν υπάρχουν περισσότερα πρωτόνια από ηλεκτρόνια, το ιόν αναφέρεται ως κατιόν. Εάν υπάρχουν περισσότερα ηλεκτρόνια, το ιόν αναφέρεται ως ανιόν.
Τα ιόντα είναι εξαιρετικά αντιδραστικά μόρια. Βρίσκονται κυρίως σε αέρια κατάσταση και δεν είναι άφθονα στη Γη. Όπως τα ηλεκτρικά φορτία τα απωθούν, ενώ τα αντίθετα φορτία τα προσελκύουν.
Το μέγεθος ενός ατόμου καθορίζεται από το ηλεκτρονιακό του νέφος. περισσότερα ηλεκτρόνια (ανιόντα) ενισχύουν την απώθηση ηλεκτρονίων, με αποτέλεσμα ένα μεγαλύτερο ιόν, ενώ τα κατιόντα (με λιγότερα ηλεκτρόνια) είναι μικρότερα από το άτομο, επειδή υπάρχουν λιγότερα ηλεκτρόνια στο νέφος που απορρίπτουν το ένα το άλλο.




