Πώς επηρεάζουν οι αλλαγές στη θερμοκρασία και την ενέργεια χημικές αλλαγές;
Αντίκτυπος της θερμοκρασίας:
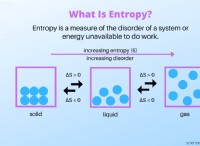
* Κινητική ενέργεια: Η θερμοκρασία είναι ένα μέτρο της μέσης κινητικής ενέργειας των μορίων. Οι υψηλότερες θερμοκρασίες σημαίνει ότι τα μόρια κινούνται ταχύτερα, συγκρούονται συχνότερα και με μεγαλύτερη δύναμη.
* Θεωρία σύγκρουσης: Για να συμβούν χημικές αντιδράσεις, τα μόρια πρέπει να συγκρούονται με επαρκή ενέργεια για να σπάσουν τους υπάρχοντες δεσμούς και να σχηματίσουν νέες. Η αυξημένη θερμοκρασία παρέχει αυτήν την απαραίτητη ενέργεια, επιταχύνοντας τους ρυθμούς αντίδρασης.
* Ισορροπία: Σε αναστρέψιμες αντιδράσεις, οι αλλαγές θερμοκρασίας μπορούν να μετατοπίσουν τη θέση ισορροπίας.
* ενδοθερμικές αντιδράσεις: Οι αντιδράσεις που απορροφούν τη θερμότητα (ενδοθερμική) ευνοούν τον σχηματισμό προϊόντων σε υψηλότερες θερμοκρασίες.
* Εξοθερμικές αντιδράσεις: Οι αντιδράσεις που απελευθερώνουν θερμότητα (εξωθερμική) ευνοούν τον σχηματισμό αντιδραστηρίου σε υψηλότερες θερμοκρασίες.
* Ενέργεια ενεργοποίησης: Η θερμοκρασία επηρεάζει την ενέργεια ενεργοποίησης, η οποία είναι η ελάχιστη ενέργεια που απαιτείται για την εμφάνιση αντίδρασης. Οι υψηλότερες θερμοκρασίες μειώνουν την ενέργεια ενεργοποίησης, καθιστώντας πιο πιθανές τις αντιδράσεις.
Η επιρροή της ενέργειας:
* Εισαγωγή ενέργειας: Οι χημικές αντιδράσεις μπορούν να ξεκινήσουν και να οδηγούνται από διάφορες μορφές ενέργειας:
* Θερμότητα: Η προσθήκη θερμότητας αυξάνει άμεσα τη μοριακή κινητική ενέργεια.
* φως: Τα φωτόνια φωτός μπορούν να παρέχουν την ενέργεια που απαιτείται για να σπάσει τους δεσμούς και να ξεκινήσει αντιδράσεις (π.χ. φωτοσύνθεση).
* Ηλεκτρική ενέργεια: Η ηλεκτρική ενέργεια μπορεί να χρησιμοποιηθεί για την προώθηση αντιδράσεων που δεν θα εμφανίζονται αυθόρμητα (π.χ. ηλεκτρόλυση).
* Ενεργειακή έξοδος: Πολλές χημικές αντιδράσεις απελευθερώνουν ενέργεια, συχνά με τη μορφή θερμότητας (εξωθερμική). Αυτή η ενέργεια μπορεί να χρησιμοποιηθεί για την οδήγηση άλλων διαδικασιών ή αντιδράσεων.
Παραδείγματα:
* μαγείρεμα: Η αύξηση της θερμοκρασίας ενός μαγειρικού συστατικού επιταχύνει τις χημικές αντιδράσεις που εμπλέκονται στο φαγητό μαγειρέματος, επιτρέποντας ταχύτερους χρόνους μαγειρέματος.
* καύση: Το καύσιμο καυσίμου (όπως το ξύλο ή η βενζίνη) είναι μια εξωθερμική αντίδραση που οδηγείται από την εισροή ενέργειας από μια σπινθήρα ή φλόγα.
* φωτοσύνθεση: Τα φυτά χρησιμοποιούν ενέργεια ηλιακού φωτός για να οδηγήσουν την ενδοθερμική αντίδραση της μετατροπής του διοξειδίου του άνθρακα και του νερού σε γλυκόζη.
* Εκρήξεις: Οι εκρήξεις είναι ταχείες εξωθερμικές αντιδράσεις όπου η ενέργεια απελευθερώνεται γρήγορα, προκαλώντας ξαφνική επέκταση του όγκου.
Βασικές έννοιες:
* Ενέργεια ενεργοποίησης: Η ελάχιστη ενέργεια που απαιτείται για την εμφάνιση αντίδρασης.
* Θεωρία σύγκρουσης: Οι αντιδράσεις εμφανίζονται όταν τα μόρια συγκρούονται με επαρκή ενέργεια και τον σωστό προσανατολισμό.
* Ισορροπία: Μια κατάσταση όπου τα ποσοστά των εμπρόσθιων και αντίστροφων αντιδράσεων είναι ίσοι.
* endothermic: Αντιδράσεις που απορροφούν θερμότητα.
* Exothermic: Αντιδράσεις που απελευθερώνουν θερμότητα.
Συνοπτικά, η θερμοκρασία και η ενέργεια επηρεάζουν άμεσα τον ρυθμό, την κατεύθυνση και τη σκοπιμότητα των χημικών αλλαγών. Η κατανόηση αυτών των σχέσεων είναι ζωτικής σημασίας για την πρόβλεψη και τον έλεγχο των χημικών αντιδράσεων σε διάφορους τομείς, από τη χημεία έως τη βιολογία και τη μηχανική.