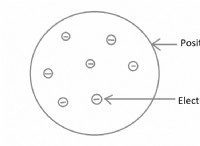
Μπορούν τα μόρια του νερού να μπορούν να τραβήξουν ιοντικές ενώσεις μεταξύ τους;
* Πόλη του νερού: Τα μόρια του νερού είναι πολικά, που σημαίνει ότι έχουν ελαφρώς θετικό τέλος (κοντά στα άτομα υδρογόνου) και ένα ελαφρώς αρνητικό άκρο (κοντά στο άτομο οξυγόνου).
* Ιωνικές ενώσεις: Οι ιοντικές ενώσεις αποτελούνται από θετικά φορτισμένα ιόντα (κατιόντα) και αρνητικά φορτισμένα ιόντα (ανιόντα) που συγκρατούνται με ηλεκτροστατική έλξη.
* αλληλεπίδραση: Όταν τα μόρια του νερού συναντούν μια ιοντική ένωση, τα θετικά άκρα των μορίων του νερού προσελκύονται από τα αρνητικά ιόντα (ανιόντα) της ένωσης και τα αρνητικά άκρα των μορίων του νερού προσελκύονται από τα θετικά ιόντα (κατιόντα).
* Τραβώντας: Αυτά τα αξιοθέατα μεταξύ των μορίων του νερού και των ιόντων είναι αρκετά ισχυρά ώστε να ξεπεραστούν η ηλεκτροστατική έλξη που συγκρατεί τα ιόντα μαζί στην ιοντική ένωση. Αυτό αποδυναμώνει τους ιοντικούς δεσμούς, επιτρέποντας στα ιόντα να διαχωριστούν και να περιβάλλονται από μόρια νερού.
Σκεφτείτε το έτσι: Φανταστείτε ότι τα ιόντα είναι σαν μαγνήτες, προσελκύοντας ο ένας τον άλλον. Τα μόρια του νερού είναι σαν μικρότεροι μαγνήτες που μπορούν να περιβάλλουν τους μεγαλύτερους μαγνήτες και να τα τραβήξουν χωριστά.
Παράγοντες που επηρεάζουν τη διάλυση:
* δύναμη του ιοντικού δεσμού: Οι ισχυρότεροι ιοντικοί δεσμοί απαιτούν περισσότερη ενέργεια για να σπάσει, καθιστώντας την ένωση λιγότερο διαλυτή στο νερό.
* Πόλη της ιοντικής ένωσης: Περισσότερες πολικές ιοντικές ενώσεις διαλύονται ευκολότερα από το νερό.
* Θερμοκρασία: Η αύξηση της θερμοκρασίας αυξάνει γενικά τη διαλυτότητα των ιοντικών ενώσεων στο νερό.
Συνοπτικά: Η πολική φύση του νερού του επιτρέπει να αλληλεπιδρά με και να απομακρύνει τα ιόντα σε ιοντικές ενώσεις, οδηγώντας στη διάλυση τους.