Τι καθορίζει το σχήμα ενός ατόμου;
1. Διαμόρφωση ηλεκτρονίων:
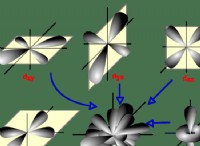
* Orbitals: Τα ηλεκτρόνια βρίσκονται σε συγκεκριμένες περιοχές του χώρου γύρω από τον πυρήνα που ονομάζονται τροχιακά. Κάθε τροχιά έχει ένα μοναδικό σχήμα και ενεργειακό επίπεδο.
* Shell and Subshell: Τα τροχιακά ομαδοποιούνται σε κελύφη (επίπεδα ενέργειας) και υποβρύχια (τύποι τροχιακών μέσα σε ένα κέλυφος). Για παράδειγμα, το πρώτο κέλυφος έχει μόνο ένα subshell S, ενώ το δεύτερο κέλυφος έχει S και P subshells.
* Παραγγελία συμπλήρωσης: Τα ηλεκτρόνια συμπληρώνουν τροχιακά σύμφωνα με συγκεκριμένους κανόνες (αρχή Aufbau, κανόνας του Hund, Pauli Exclusion Principle). Αυτή η σειρά πλήρωσης υπαγορεύει τη διάταξη των ηλεκτρονίων και επομένως το συνολικό σχήμα του ατόμου.
2. Απομάκρυνση ηλεκτρονίων-ηλεκτρονίων:
* ηλεκτρόνια σθένους: Τα ηλεκτρόνια στο εξωτερικό κέλυφος, που ονομάζονται ηλεκτρόνια σθένους, είναι υπεύθυνα για τη χημική σύνδεση και την επιρροή του σχήματος του ατόμου.
* Απομάκρυνση: Τα ηλεκτρόνια, που είναι αρνητικά φορτισμένα, απωθούν ο ένας τον άλλον. Αυτή η απόρριψη επηρεάζει τη χωρική διάταξη των ηλεκτρονίων, με αποτέλεσμα ένα συγκεκριμένο σχήμα.
3. Μοριακή γεωμετρία:
* δεσμός: Όταν τα άτομα δεσμεύονται για να σχηματίσουν μόρια, η γεωμετρία του μορίου καθορίζεται από τη διάταξη των ατόμων, η οποία με τη σειρά του επηρεάζεται από το σχήμα των ατομικών ατόμων.
* Θεωρία VSEPR: Η θεωρία απάντησης ηλεκτρονίων (VSEPR) του ζεύγους (VSEPR) βοηθά στην πρόβλεψη του σχήματος των μορίων λαμβάνοντας υπόψη την απόρριψη μεταξύ ζευγών ηλεκτρονίων (τόσο συγκόλλησης όσο και μη σύνδεσης) γύρω από ένα κεντρικό άτομο.
Παράδειγμα:
Εξετάστε ένα μόριο νερού (H₂O).
* Atom Oxygen: Έχει οκτώ ηλεκτρόνια, με δύο μοναχικά ζεύγη στο εξωτερικό του κέλυφος και δύο ζεύγη συγκόλλησης με άτομα υδρογόνου.
* διάταξη ηλεκτρονίων: Τα μοναχικά ζεύγη απωθούν μεταξύ τους και τα ζεύγη συγκόλλησης, με αποτέλεσμα μια λυγισμένη ή γεωμετρία σχήματος V.
* Μοριακό σχήμα: Το συνολικό σχήμα του μορίου νερού δεν είναι σφαιρικό, αλλά μάλλον λυγισμένο, λόγω της διάταξης των ηλεκτρονίων του.
Συνοπτικά, το σχήμα ενός ατόμου καθορίζεται από την αλληλεπίδραση μεταξύ της διάταξης των ηλεκτρονίων του, της απόρριψης μεταξύ αυτών των ηλεκτρονίων και τα προκύπτοντα πρότυπα συγκόλλησης που σχηματίζουν μόρια.