Υποχλωριώδες οξύ – Δομή, Ιδιότητες, Χρήσεις HOCl
Τα υποχλωρικά οξέα είναι αδύναμα οξέα που περιέχουν υδρογόνο, οξυγόνο και χλώριο. Αν και ασθενές οξύ με pKa=7,5, το υποχλωριώδες οξύ είναι ισχυρός οξειδωτικός παράγοντας. Είναι υπεύθυνο για τη θανάτωση των παθογόνων από τα φαγοκύτταρα.
Τι είναι το HOCl;
Το υποχλωριώδες οξύ είναι ένα ασθενές οξύ. Ο χημικός του τύπος είναι HOCl.
Άλλα ονόματα: Έχει επίσης πολλά άλλα ονόματα, όπως:
- Υδροξείδιο του χλωρίου
- υποχλωριώδες υδρογόνο
- Υποχλωρικό οξύ
- Υδροξειδοχλωρίνη (το όνομα IUPAC)
- Χλωρικό (Ι) οξύ
- Υδροξείδιο του χλωρίου
- Χλωρανόλη
Συχνά αναφέρεται ως οξυοξύ του χλωρίου.
Ανακάλυψη: Ένας Γάλλος χημικός, ο Antoine Ballard, ανακάλυψε το υποχλωριώδες οξύ το 1834. Το μονοσθενές χλώριο του λειτουργεί ως οξειδωτικός ή αναγωγικός παράγοντας. Χρησιμεύει ως ανθρώπινος μεταβολίτης. Το υποχλωριώδες οξύ είναι ένα ασταθές οξύ. Είναι το συζευγμένο οξύ του υποχλωριώδους και ανήκει στην οικογένεια του αντιδραστικού οξυγόνου.
Τύπος και δομή υποχλωρικού οξέος
Ο τύπος του υποχλωρικού οξέος είναι HOCl ή HClO. Η δομή Lewis του υποχλωριώδους οξέος είναι η εξής:
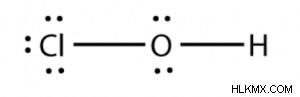
Lewis Structure of Hypochlorous Acid
Έτσι, από την παραπάνω δομή, μπορείτε να συμπεράνετε ως εξής:
- Έχει δύο ζεύγη ομοιοπολικών δεσμών.
- Έχει πέντε μεμονωμένα ζεύγη ηλεκτρονίων.
- Υπάρχουν δέκα μη δεσμευτικά ηλεκτρόνια στο HOCl.
Το σχήμα του HOCl είναι λυγισμένο, όπως παρουσιάζεται στο παρακάτω διάγραμμα,
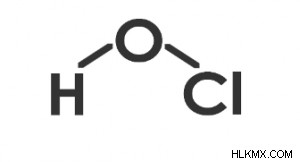
Δομή του HOCl
Η παρουσία του ατόμου υδρογόνου στην ένωση υποδηλώνει ότι πρόκειται για οξύ. Τείνει να αποπρωτονίζεται, δηλαδή χάνει το ιόν υδρογόνου του.
Ιδιότητες του HOCl-Υποχλωρικού οξέος
Η τιμή pKa του υποχλωριώδους οξέος είναι σχετικά υψηλή. Είναι 7,53. Αυτή η αρνητική λογαριθμική βάση δέκα της σταθεράς διάστασης οξέος υποδηλώνει μικρότερη διάσταση οξέος. Ως εκ τούτου, αποδεικνύεται ότι το HOCl είναι ασθενές οξύ. Αυτό το οξύ διασπάται εν μέρει στα συστατικά του ιόντα και η αδυναμία είναι ο λόγος για την αδύναμη φύση του.
Το οξύ HOCl είναι ένα άχρωμο υγρό σε θερμοκρασία δωματίου. Το χλώριο του είναι ήπιο και εξαφανίζεται γρήγορα. Είναι ένα πολικό μόριο. Η διαφορά στις ηλεκτραρνητικότητες των ατόμων και των μοναχικών ζευγών ηλεκτρονίων δημιουργεί μια ανομοιόμορφη κατανομή φορτίου. Αυτή η ασύμμετρη κατανομή προκαλεί πολικότητα. Η γεύση του υποχλωριώδους οξέος δεν είναι επακριβώς γνωστή και η καθαρή του μορφή είναι ασταθής. Το υποχλωριώδες οξύ υπάρχει κυρίως ως υδατικό διάλυμα στο νερό.
Το οξύ HOCl είναι ένα οξοξύ, δηλαδή ένα οξύ που περιέχει ένα άτομο οξυγόνου. Ακολουθεί μια περίληψη των σημαντικών ιδιοτήτων του οξέος HOCl.
- Μοριακή μάζα ή μοριακό βάρος:52,457 g/mol
- Μονοϊσοτοπική μάζα:51,972 g/mol
- Αρ. αποδέκτη δεσμού υδρογόνου:1
- Δότης δεσμού υδρογόνου:1
- Φυσική κατάσταση:Υγρό
- Χρώμα:Άχρωμο
- Διαλυτότητα:Υδατοδιαλυτή
- Οσμή:Πικάντικη, σαν χλώριο
- Δύναμη οξέος:Ασθενής
- Οξύτητα pKa:7,53
- Διαβρωτικότητα:Διαβρωτικό
- Τοξικότητα:Τοξικό
- Πολικότητα:Πολική
- Σχήμα:Λυγισμένο
Υπολογισμός του μοριακού βάρους του υποχλωριώδους οξέος
Για να υπολογίσετε τη μοριακή μάζα ή το μοριακό βάρος του υποχλωριώδους οξέος, πρέπει να γνωρίζετε την ατομική μάζα των ατόμων που το αποτελούν:
Χλώριο =35,5
Υδρογόνο =1
Οξυγόνο =16
Έτσι, το μοριακό βάρος του HOCl μπορεί να υπολογιστεί ως εξής:
=Μοριακό βάρος υδρογόνου + οξυγόνου + χλωρίου
=1 + 16 + 35,5
=52,5 g/mol
Έτσι, το μοριακό βάρος του HOCl είναι 52,5 g/mol.
Χρήσεις υποχλωρικού οξέος
Όπως αναφέρθηκε προηγουμένως, η κύρια χρήση του υποχλωριώδους οξέος είναι ως απολυμαντικός παράγοντας. Ωστόσο, οι χρήσεις του δεν περιορίζονται στη θανάτωση μικροβίων. Το οξύ βρίσκει διάφορες άλλες εφαρμογές σε διαφορετικές βιομηχανίες. Η ακόλουθη λίστα συνοψίζει τις βασικές χρήσεις του οξέος HOCl:
- Είναι συστατικό σε πολλά καταναλωτικά είδη όπως τα αποσμητικά.
- Μπορεί να βρεθεί φυσικά στα λευκά αιμοσφαίρια των θηλαστικών, συμπεριλαμβανομένων των ανθρώπων.
- Σε συσκευές θαλάσσιας υγιεινής όπου το θαλασσινό νερό μετατρέπεται σε HOCl.
- Χρησιμοποιείται για τη μετατροπή αλκενίων σε χλωροϋδρίνες.
- Το HOCl χρησιμοποιείται επίσης σε καλλυντικά όπως τα βρεφικά προϊόντα.
- Προστίθεται σε πισίνες.
- Στην κατασκευή ασφαλών απολυμαντικών
- Χρησιμοποιείται ευρέως για σκοπούς φροντίδας τραυμάτων.
- Για τη θεραπεία πολλών λοιμώξεων σε ανθρώπους και κατοικίδια
- Το HOCl έχει αποδειχθεί ότι καθαρίζει, ηρεμεί και καταπραΰνει το δέρμα. Το σπρέι υποχλωριώδους οξέος χρησιμοποιείται συχνά για τη θεραπεία της ερυθρότητας και άλλων επιβλαβών αλλαγών από την έκθεση σε επιβλαβείς ουσίες.
- Το υποχλωριώδες νάτριο χρησιμοποιείται στους ριζικούς σωλήνες στην οδοντιατρική.
Η χρήση του υποχλωριώδους οξέος στο δέρμα
Το HOCl υπάρχει στο ανθρώπινο σώμα. Κατασκευάζεται από λευκά αιμοσφαίρια για άμυνα έναντι βακτηρίων, λοιμώξεων και γενικής αδιαθεσίας.
Επιτίθεται σε εισβάλλοντα παθογόνα και χρησιμεύει ως αντιμικροβιακό οξύ. Το ανθρώπινο δέρμα είναι σκληρό και ανθεκτικό, λειτουργώντας ως εξωτερικό προστατευτικό φράγμα. Αυτή η άμυνα πρώτης γραμμής συχνά αφήνει το δέρμα σας ευάλωτο σε κοψίματα, σκόνη, γρατζουνιές και πολλά άλλα. Το HOCl προσφέρει στο δέρμα σας κάποιο επιπλέον αντίγραφο ασφαλείας μέσω
- Καταπολέμηση βακτηρίων που οδηγούν σε φραγμένους πόρους και ακμή.
- Επιτάχυνση επιδιόρθωσης ζημιών και επούλωσης πληγών.
- Καταπολέμηση της φλεγμονής και των δερματικών προβλημάτων όπως το έκζεμα ή η ψωρίαση.
Έτσι, το σπρέι υποχλωριώδους οξέος ενσωματώνεται σε μια καθημερινή ρουτίνα συντήρησης του δέρματος για την εξάλειψη των επιβλαβών βακτηρίων. Ωστόσο, όσοι έχουν ευαίσθητο δέρμα πρέπει να μείνουν μακριά από τα σπρέι HOCl με άρωμα.
Παραγωγή Οξέος HOCl
Το υποχλωριώδες οξύ λαμβάνεται όταν το χλώριο (Cl2 ) διασπάται μερικώς στο νερό (H2 Ο) να δώσει ένα υποχλωριώδες ιόν (ClO). Κατά την πρωτονίωση, μετατρέπεται σε HClO όταν το οξυγόνο συνδέεται με το υδρογόνο από τα μόρια του νερού. Η ακόλουθη εξίσωση δείχνει το σχηματισμό υποχλωριώδους οξέος:
Cl2 + H2 O ⇌ HClO + HCl
Πρέπει να σημειωθεί ότι ο σχηματισμός υποχλωριώδους οξέος προκαλεί επίσης ένα υδατικό διάλυμα υδροχλωρίου HCl.
Χημικές αντιδράσεις
Ακολουθούν ορισμένες σημαντικές χημικές αντιδράσεις του οξέος HOCl.
Διάσπαση
Το υποχλωριώδες οξύ διασπάται μερικώς σε υποχλωριώδες ανιόν ClO σε υδατικά διαλύματα. Η αντίδραση διάστασης φαίνεται παρακάτω:
HClO ⇌ ClO + H
Αυτό το υποχλωριώδες ανιόν σχηματίζει διάφορα άλατα. Ένα κοινό υποχλωριώδες-υποχλωριώδες νάτριο (NaClO) είναι ένα συστατικό στο λευκαντικό.
Οξείδωση
Όπως αναφέρεται στις σημαντικές ιδιότητες, το υποχλωριώδες οξύ είναι ένας ισχυρός οξειδωτικός παράγοντας. Είναι ισχυρότερο οξειδωτικό από το χλώριο, υπό τυπικές συνθήκες.
2 HClO(aq) + 2 H+ + 2 e− ⇌ Cl2(g) + 2 H2 O
Αντίδραση με HCl
Αντιδρά με HCl ή υδροχλωρικό οξύ για να δώσει αέριο χλώριο. Η χημική αντίδραση είναι η εξής:
HClO + HCl → H2 O + Cl2
Αντίδραση με αμμωνία
Αντιδρά με την αμμωνία και παράγει χλωραμίνες και νερό. Η ισορροπημένη αντίδραση είναι η εξής:
NH3 + HClO → NH2 Cl + H2 O
Αντίδραση με λιπίδια
Το υποχλωριώδες οξύ αντιδρά με τα λιπίδια μοναδικά. Αντιδρά μόνο με ακόρεστους δεσμούς λιπιδίων και όχι με κορεσμένους δεσμούς. Το υποχλωριώδες ιόν ή το ClOdo δεν συμμετέχουν στην αντίδραση.
Η αντίδραση περιλαμβάνει υδρόλυση και προσθήκη χλωρίου σε ένα άτομο άνθρακα και υδροξυλίου στο άλλο άτομο άνθρακα. Η διαδικασία οδηγεί στο σχηματισμό χλωροϋδρίνης. Ο σχηματισμός χλωροϋδρίνης στις λιπιδικές διπλές στοιβάδες των RBC αυξάνει τη διαπερατότητά τους. Έτσι, μπορεί να προκύψουν διαταραχές εάν σχηματιστεί περισσότερη χλωροϋδρίνη.
Είναι ασφαλές για χρήση το υποχλωριώδες οξύ;
Η EPA (Environmental Protection Agency, ΗΠΑ) θεωρεί το υποχλωριώδες οξύ μη επικίνδυνο.
Ωστόσο, είναι ένας οξειδωτικός παράγοντας και μπορεί να είναι διαβρωτικός ανάλογα με το pH και τη συγκέντρωσή του. Έχουν διεξαχθεί αρκετές κλινικές δοκιμές για τον έλεγχο του νερού με υποχλωριώδες οξύ για ερεθισμό των ματιών και του δέρματος. Βγήκε το συμπέρασμα ότι το νερό HOCl είναι μη τοξικό και δεν προκαλεί ερεθισμούς στο δέρμα και τα μάτια.
Μια μελέτη του 2017 επιβεβαίωσε ότι ένα αλατούχο διάλυμα υγιεινής, όταν συντηρήθηκε με καθαρό υποχλωριώδες οξύ, είχε μειωμένο βακτηριακό φορτίο χωρίς να αλλοιώσει την ποικιλία των βακτηριακών ειδών στα βλέφαρα. Υπήρξε μείωση 99% στα βακτήρια μετά από 20 λεπτά θεραπείας.
Επιπλέον, το υποχλωριώδες οξύ είναι αρκετά ασταθές και οι δραστικές ενώσεις εύκολα αλλοιώνονται ξανά σε αλμυρό νερό. Έτσι, χάνει εύκολα την απολυμαντική του ικανότητα. Αυτή η ιδιότητα καθιστά δύσκολη τη μεταφορά του HOCl. Επίσης, το υψηλό κόστος του το καθιστά λιγότερο δημοφιλές για χρήση ως απολυμαντικό σε σύγκριση με το αλκοόλ και το λευκαντικό. Με την τεχνολογική πρόοδο, το κόστος παραγωγής του νερού με υποχλωρό οξύ έχει μειωθεί σημαντικά για οικιακή και εμπορική χρήση. Ωστόσο, η σύντομη διάρκεια ζωής του εξακολουθεί να προκαλεί ανησυχία.
Συμπέρασμα
Το υποχλωριώδες οξύ είναι ένα πολύ χρήσιμο ήπιο οξύ. Περιέχει χλώριο, οξυγόνο και υδρογόνο. Έχει λυγισμένη δομή και είναι μια ασταθής ένωση. Διάσημο για τις αντιβακτηριδιακές του ιδιότητες, το HOCl είναι ασφαλές για τοπικές εφαρμογές παρά το γεγονός ότι είναι οξύ. Είναι ένας ενεργός παράγοντας περιποίησης τραυμάτων και το σπρέι του χρησιμοποιείται επίσης για τη θεραπεία δερματικών προβλημάτων.
Συχνές ερωτήσεις
Ε1. Τι συμβαίνει όταν ένα οξύ προστίθεται στο υδατικό άλας του HOCl;
Α. Όταν ένα προστίθεται στα υδατικά άλατα του υποχλωριώδους οξέος όπως το υποχλωριώδες νάτριο σε διαλύματα λευκαντικού, η αντίδραση ωθείται προς τα αριστερά. Έχει ως αποτέλεσμα το σχηματισμό αερίου χλωρίου. Το αέριο χλώριο διαλύεται σε απλά διαλύματα νερού όπως το υδροξείδιο του νατρίου. Έτσι, σχηματίζονται στερεά υποχλωριώδες λευκαντικά.
Ε2. Πώς αντιδρά το οξύ HOCl με τα αμινοξέα;
Α. Το υποχλωριώδες οξύ και τα αμινοξέα αντιδρούν εύκολα επειδή τα τελευταία διαθέτουν πλευρικές αλυσίδες. Το υποχλωριώδες οξύ χλώριο εκτοπίζει το υδρογόνο στα αμινοξέα, με αποτέλεσμα το σχηματισμό οργανικής χλωραμίνης. Ωστόσο, τα χλωριωμένα αμινοξέα διασπώνται γρήγορα σε αντίθεση με τις πρωτεϊνικές χλωραμίνες, οι οποίες διαρκούν περισσότερο.
Ε3. Γιατί το οξυγόνο και όχι το χλώριο είναι το κεντρικό άτομο στο HOCl;
Α. Η δομή συνήθως κατασκευάζεται με τον προσδιορισμό του λιγότερο ηλεκτραρνητικού ατόμου. Το λιγότερο ηλεκτραρνητικό άτομο τοποθετείται στη συνέχεια στο κέντρο. Στο HOCl, η ηλεκτραρνητικότητα του Οξυγόνου είναι 3,44. το χλώριο είναι 3,16. Η ηλεκτραρνητικότητα του υδρογόνου είναι 2,2. Άρα, το υδρογόνο είναι το λιγότερο ηλεκτραρνητικό άτομο. Ωστόσο, δεν μπορεί να είναι το κεντρικό άτομο γιατί μπορεί να σχηματίσει μόνο έναν ενιαίο δεσμό. Το χλώριο έρχεται μετά από άποψη ελάχιστης ηλεκτραρνητικότητας. Ωστόσο, δεν μπορεί να είναι το κεντρικό άτομο, καθώς το οξυγόνο θα πρέπει να συνδέεται απευθείας με το υδρογόνο, καθώς το χλώριο στο κέντρο θα εμπόδιζε τη δομή. Έτσι, ακόμη και με την υψηλότερη ηλεκτραρνητικότητα, το οξυγόνο είναι το κεντρικό άτομο.




