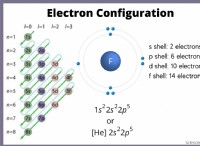
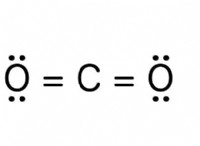Γιατί οι ομοιοπολικοί δεσμοί είναι ασθενέστεροι από τους ιοντικούς δεσμούς;
Οι ομοιοπολικοί δεσμοί μπορεί να είναι ασθενέστεροι, ισχυρότεροι ή παρόμοιοι σε αντοχή με ιοντικούς δεσμούς, ανάλογα με τα συγκεκριμένα μόρια που εμπλέκονται.
Εδώ είναι γιατί:
* Ιονική δύναμη δεσμού: Οι ιοντικοί δεσμοί σχηματίζονται από την ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων. Αυτό το αξιοθέατο μπορεί να είναι πολύ ισχυρό, ειδικά όταν τα ιόντα έχουν υψηλές χρεώσεις και μικρές ακτίνες.
* Αντοχή ομοιοπολικού δεσμού: Οι ομοιοπολικοί δεσμοί σχηματίζονται από την κατανομή ηλεκτρονίων μεταξύ των ατόμων. Η αντοχή ενός ομοιοπολικού δεσμού εξαρτάται από:
* Διαφορά ηλεκτροαρνητικότητας: Όσο μεγαλύτερη είναι η διαφορά ηλεκτροαρνητικότητας μεταξύ των ατόμων, τόσο πιο πολικός είναι ο δεσμός και τόσο πιο αδύναμη τείνει να είναι.
* Παραγγελία δεσμού: Ο αριθμός των κοινόχρηστων ζευγών ηλεκτρονίων (μονή, διπλά, τριπλούς δεσμούς) επηρεάζει την αντοχή του δεσμού. Περισσότερα κοινά ζεύγη οδηγούν σε ισχυρότερους δεσμούς.
* Ατομικό μέγεθος: Τα μικρότερα άτομα σχηματίζουν ισχυρότερους δεσμούς λόγω μεγαλύτερης πυκνότητας ηλεκτρονίων και ισχυρότερη αλληλεπικάλυψη τροχιακών.
Εδώ είναι μερικά παραδείγματα για να απεικονίσετε:
* Ισχυρό ομοιοπολικό δεσμό: Ο τριπλός δεσμός σε αέριο αζώτου (N =N) είναι εξαιρετικά ισχυρός λόγω της τάξης υψηλού δεσμού.
* Αδύναμος ιοντικός δεσμός: Ο ιοντικός δεσμός στο φθορίδιο του καισίου (CSF) είναι σχετικά ασθενής επειδή το καισίριο έχει μεγάλη ιοντική ακτίνα, με αποτέλεσμα την ασθενέστερη ηλεκτροστατική έλξη.
Παράγοντες που συμβάλλουν στην αντίληψη ότι οι ομοιοπολικοί δεσμοί είναι ασθενέστεροι:
* Πολλοί ομοιοπολικοί δεσμοί είναι ασθενέστεροι από τους τυπικούς ιοντικούς δεσμούς: Αυτό ισχύει συχνά για μεμονωμένους ομοιοπολικούς δεσμούς μεταξύ ατόμων που δεν ανήκουν σε μέταλλα με παρόμοιες ηλεκτροναυτικές ιδιότητες.
* ομοιοπολικοί δεσμοί μπορούν εύκολα να σπάσουν: Αυτό ισχύει ιδιαίτερα για τα οργανικά μόρια, όπου οι ομοιοπολικοί δεσμοί μπορούν να σπάσουν με σχετικά ήπιες συνθήκες (θερμότητα, φως κλπ.).
* Ιωνικές ενώσεις τείνουν να έχουν υψηλότερα σημεία τήξης και βρασμού: Αυτό οφείλεται στο γεγονός ότι η παραβίαση των ισχυρών ηλεκτροστατικών δυνάμεων σε ιοντικούς δεσμούς απαιτεί περισσότερη ενέργεια.
Συμπερασματικά:
Ενώ είναι μια κοινή εσφαλμένη αντίληψη να πούμε ότι οι ομοιοπολικοί δεσμοί είναι πάντα ασθενέστεροι από τους ιοντικούς δεσμούς, η δύναμη ενός δεσμού καθορίζεται από διάφορους παράγοντες. Και οι δύο τύποι δεσμών μπορεί να είναι ισχυροί και τα σχετικά πλεονεκτήματα τους εξαρτώνται από τα συγκεκριμένα άτομα και τα μόρια που εμπλέκονται.