Τι είναι η εντολή ομολόγων;
Η σειρά δεσμών ενός μορίου είναι ο μέσος όρος των τάξεων δεσμών όλων των πιθανών δομών που το περιγράφουν.
Είκοσι χρόνια πριν την ανάπτυξη της κβαντικής μηχανικής, ο Αμερικανός επιστήμονας G.N. Ο Lewis συνειδητοποίησε ότι τα μόρια πρέπει να συνδυάζονται και να οργανώνονται σύμφωνα με μια συγκεκριμένη αρχή. Η θεωρία του επικεντρώθηκε στους ομοιοπολικούς δεσμούς, οι οποίοι, σε αντίθεση με τους ιοντικούς δεσμούς, δεν απαιτούσαν ανταλλαγή ηλεκτρονίων σθένους, αλλά αντίθετα απαιτούσαν από τα άτομα να μοιράζονται μερικά από αυτά. Τα άτομα μοιράζονται τόσα ηλεκτρόνια όσα απαιτούνται για να γεμίσουν πλήρως το κέλυφος σθένους.
Σειρά δεσμών σύμφωνα με τη θεωρία του δεσμού σθένους
Ο Lewis σχεδίασε μικρά διαγράμματα για να απεικονίσει αυτή τη συντροφικότητα, τα οποία τώρα ονομάζονται δομές Lewis. Μια δομή Lewis περιγράφει τη δομή ενός μορίου συνδέοντας τα άτομα με γραμμές. Οι γραμμές αντιπροσωπεύουν τον αριθμό των ηλεκτρονίων που έχουν μοιραστεί μεταξύ δύο ή περισσότερων ατόμων. Έτσι, όταν δύο άτομα μοιράζονται δύο ηλεκτρόνια, το απεικονίζουμε συνδέοντάς τα με δύο γραμμές. Ο αριθμός των γραμμών, ή ακριβέστερα, ο αριθμός των χημικών δεσμών που αποτελούν ένα μόριο, ονομάζεται σειρά δεσμών του.
Για παράδειγμα, η σειρά δεσμών του διοξειδίου του άνθρακα και του μεθανίου είναι 4, η οποία μπορεί εύκολα να διακριθεί εξετάζοντας τις δομές Lewis τους. Παρατηρήστε πώς το μέγεθος των ηλεκτρονίων που μοιράζονται μεταξύ κάθε ζεύγους γεμίζει επαρκώς το κέλυφος σθένους και των δύο ατόμων. Το υδρογόνο απαιτεί μόνο ένα ηλεκτρόνιο, καθώς το περίβλημά του γεμίζει όταν περιέχει 2 ηλεκτρόνια και όχι 8.
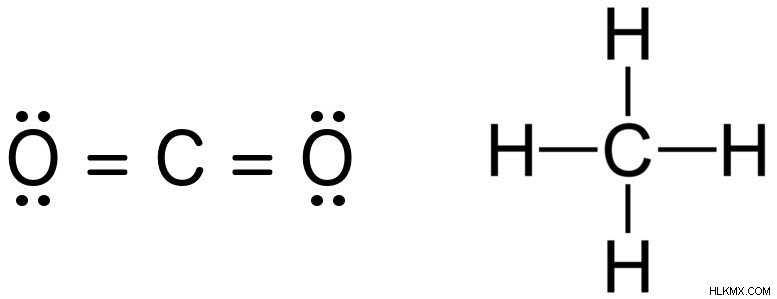
Δομές Lewis διοξειδίου του άνθρακα και μεθανίου.
Υπάρχουν επίσης μόρια που μπορούν να περιγραφούν από περισσότερες από μία δομές Lewis, όπως το διοξείδιο του θείου. Η σειρά δεσμών ενός τέτοιου μορίου είναι ο μέσος όρος των τάξεων δεσμών όλων των πιθανών δομών που το περιγράφουν. Η σειρά δεσμών του διοξειδίου του θείου είναι επομένως 1,5, όχι 3.
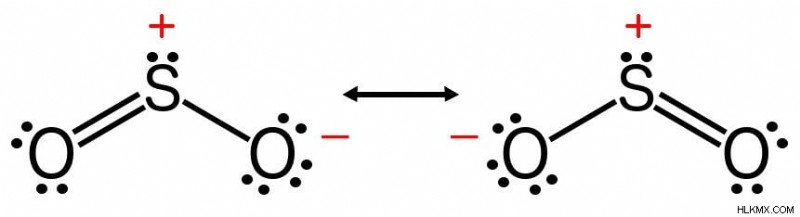
Το διοξείδιο του θείου παρουσιάζει δύο δομές Lewis.
Ωστόσο, ο υπολογισμός της σειράς δεσμών με απλή αναφορά στον αριθμό των γραμμών στη δομή Lewis ενός μορίου είναι αποδεκτός μόνο σύμφωνα με τη θεωρία του δεσμού σθένους (VB). Όταν πρόκειται για τη θεωρία του Μοριακού Τροχιακού (MO), την εναλλακτική θεωρία που περιγράφει τους μοριακούς δεσμούς, η σειρά δεσμών μπορεί να είναι η ίδια, αλλά οι συνέπειες είναι δραστικά διαφορετικές.
Θεωρία δεσμού σθένους εναντίον θεωρίας μοριακών τροχιακών
Η θεωρία του δεσμού σθένους παρέχει μια ακατέργαστη αναπαράσταση των μοριακών δομών, ενώ η θεωρία του Μοριακού Τροχιακού δίνει μια πιο ακριβή και ρεαλιστική αναπαράσταση του τρόπου με τον οποίο σχηματίζονται τα μόρια. Στο πρώτο, μπορεί κανείς να παρατηρήσει πώς τα ηλεκτρόνια που απεικονίζονται με τελείες πάνω από τα άτομα εντοπίζονται, που σημαίνει ότι η τοποθεσία τους είναι καθορισμένη. Από την άλλη πλευρά, η θεωρία MO βασίζεται στην κβαντομηχανική θεωρία των ατόμων. Λαμβάνει υπόψη το πιθανολογικό ή μη εντοπισμένο φύση των ηλεκτρονίων και τα διακριτά ενεργειακά επίπεδα που εμπλέκονται.
Δεν υπάρχει νικητής μεταξύ των δύο:η θεωρία VB είναι πιο κατανοητή, αλλά δεν εξηγεί τις μικρές, αλλά εξαιρετικά κρίσιμες λεπτομέρειες που εξηγεί η θεωρία MO με τη βοήθεια εξαιρετικά εσωτερικών και περίπλοκων εννοιών. Ωστόσο, αυτή η κατανόηση της γεωμετρίας και η λεπτομέρεια μιας μοριακής δομής έρχονται σε βάρος της ευκολίας με την οποία ένας λαϊκός μπορεί να την οπτικοποιήσει.

(Φωτογραφία :Pixabay)
Αυτός είναι ο λόγος για τον οποίο οι επιπτώσεις της θεωρίας MO μπορεί συχνά να είναι δραστικά διαφορετικές. Για παράδειγμα, η σειρά δεσμών ενός μορίου οξυγόνου βρέθηκε να είναι 2 και στις δύο θεωρίες, αλλά η θεωρία VB δεν εξηγεί τις παραμαγνητικές ιδιότητες που παρουσιάζει το οξυγόνο. Πειράματα έχουν δείξει πώς το υγρό οξυγόνο επηρεάζεται ασθενώς από ένα μαγνητικό πεδίο. Ένα άτομο εμφανίζει οποιονδήποτε τύπο μαγνητισμού όταν περιέχει ασύζευκτα ηλεκτρόνια. Αν αναφερθείτε στη δομή του οξυγόνου Lewis, θα διαπιστώσετε ότι όλα τα ηλεκτρόνια είναι ζευγαρωμένα, γεγονός που θα καθιστούσε το άτομο διαμαγνητικό ή ανεπηρέαστο από ένα μαγνητικό πεδίο. Ωστόσο, η θεωρία MO αποκαλύπτει τη δομή του οξυγόνου με την πραγματική του λεπτομέρεια. Η θεωρία MO προβλέπει σωστά την παρουσία μη ζευγαρωμένων ηλεκτρονίων στα τροχιακά του οξυγόνου και επομένως τον παραμαγνητισμό του.
Πώς να βρείτε τη σειρά δεσμών χρησιμοποιώντας τη θεωρία Μοριακών Τροχιακών
Ωστόσο, πριν προσδιορίσουμε τον αριθμό των ηλεκτρονίων σε ορισμένα τροχιακά, πρέπει πρώτα να γεμίσουμε αυτά τα τροχιακά με ηλεκτρόνια. Για να γεμίσει κανείς τα τροχιακά, πρέπει να γνωρίζει τους κανόνες σύμφωνα με τους οποίους καταλαμβάνονται τα τροχιακά. Χωρίς την κατανόηση αυτού του κανόνα, ο υπολογισμός της σειράς δεσμών ενός μορίου θα ήταν αδύνατος. Είμαι βέβαιος ότι υπάρχουν πολλά έξυπνα κόλπα ή συντομεύσεις για να καταλήξετε στον αριθμό, αλλά εάν τα μάθετε, θα στερηθήκατε σημαντικές εννοιολογικές γνώσεις.
Άτομα που γνωρίζουν τους κανόνες μπορούν να ανατρέξουν σε αυτήν την έκφραση για να υπολογίσουν τη σειρά δεσμών ενός μορίου:

Όσοι δεν γνωρίζουν δεν έχουν άλλη επιλογή από το να τα μάθουν. Αν βοηθάει, μπορεί κανείς απλά να μάθει τους κανόνες για την πλήρωση των ατομικών τροχιακών. Οι κανόνες για την πλήρωση των μοριακών τροχιακών είναι οι ίδιοι, εκτός από το ότι κάθε τροχιακό «δεσμού» ακολουθείται από ένα τροχιακό «αντι-δεσμικό». Ενώ τα ατομικά τροχιακά συμπληρώνονται ως 1s2s2p… Τα μοριακά τροχιακά συμπληρώνονται ως 1s1s*2s2s*2p…. Τα τροχιακά με αστερίσκο αντιπροσωπεύουν τροχιακά κατά των δεσμών. Δυστυχώς, οι κανόνες δεν θα επεξηγηθούν πλήρως εδώ, καθώς θα μας έκανε να παρεκκλίνουμε άσκοπα. Μπορείτε να τα βρείτε σε αυτό το άρθρο.
Οι άνθρωποι που γνωρίζουν τους κανόνες μπορούν να υπολογίσουν τη σειρά δεσμών, για παράδειγμα, του οξυγόνου χρησιμοποιώντας την παραπάνω έκφραση. Συνολικά, ένα μόνο μόριο οξυγόνου αποτελείται από 12 ηλεκτρόνια σθένους. Τώρα, σύμφωνα με τους κανόνες, τα ηλεκτρόνια πρέπει να είναι διατεταγμένα με αυτόν τον τρόπο:

Βλέπουμε ότι υπάρχουν 8 ηλεκτρόνια κατανεμημένα σε τροχιακά δεσμού, ενώ 4 είναι σε τροχιακά αντιδεσμικά. Αντικαταστήστε τους αριθμούς στην παράσταση και θα διαπιστώσετε ότι η σειρά δεσμών του οξυγόνου είναι 2.
Τα δύο τροχιακά μοιάζουν με τον Τζέκιλ και τον Χάιντ – κατοικούν στην ίδια γεωμετρία, αλλά το τροχιακό αντι-δεσμό υπάρχει σε ένα διαβόητο υψηλό ενεργειακό επίπεδο, το οποίο αρνείται τη σταθερότητα του συνδυασμού ηλεκτρονίων, ενώ το τροχιακό δεσμού υπάρχει σε μια ενέργεια όπου τα ηλεκτρόνια μπορούν άνετα δεσμεύονται, επιτρέποντας στο προκύπτον μόριο να επιτύχει σταθερότητα. Στην πραγματικότητα, η ενέργεια ενός τροχιακού δεσμού είναι χαμηλότερη από τις ενέργειες των επιμέρους επιπέδων που κατοικούν τα ηλεκτρόνια σε ένα μόνο άτομο. Αυτό σημαίνει ότι τα ηλεκτρόνια προτιμούν να συνδυάζονται και να σχηματίζουν ένα μόριο παρά να υπάρχουν ασύζευκτα.
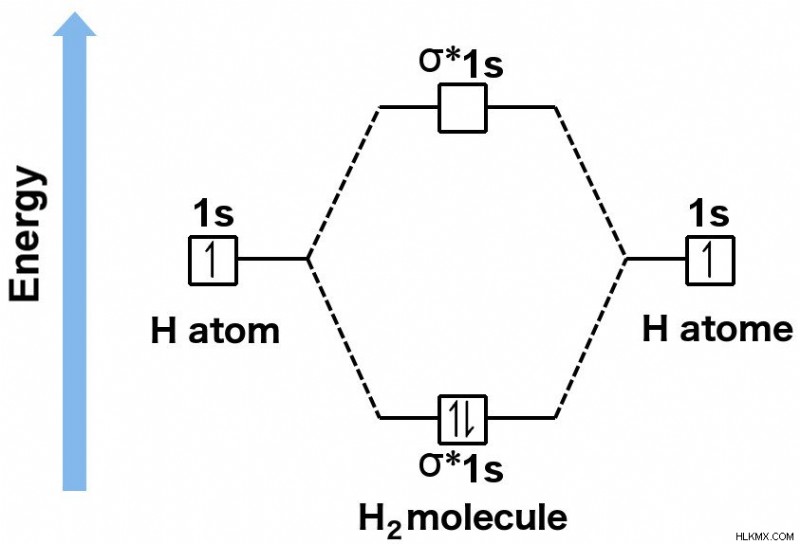
Το τροχιακό δεσμού ενός μορίου υδρογόνου υπάρχει σε χαμηλότερη ενέργεια από τα μεμονωμένα επίπεδα μεμονωμένων ατόμων υδρογόνου. Αυτό σημαίνει ότι τα ηλεκτρόνια προτιμούν να συνδυάζονται και να σχηματίζουν ένα μόριο παρά να υπάρχουν σε μη ζευγαρωμένη κατάσταση.
Συνοψίζοντας, εάν δεν είστε εξοικειωμένοι με τη θεωρία MO, μπορείτε να υπολογίσετε τη σειρά δεσμών ενός μορίου σχεδιάζοντας τη δομή Lewis του και στη συνέχεια ελέγχοντας τον συνολικό αριθμό ηλεκτρονίων που έχουν μοιραστεί (υπάρχουν αυστηροί κανόνες για τη σχεδίαση δομών Lewis ως Λοιπόν, αλλά θα υποθέσω ότι ο αναγνώστης τα γνωρίζει. Εάν όχι, ανατρέξτε σε αυτόν τον σύνδεσμο). Ωστόσο, εάν είστε εξοικειωμένοι με τη θεωρία MO, μπορείτε να υπολογίσετε τη σειρά δεσμών γεμίζοντας πρώτα τα δεσμευτικά και αντι-δεσμικά μοριακά τροχιακά με ηλεκτρόνια σθένους σύμφωνα με τους κανόνες και, στη συνέχεια, ανατρέξτε στην έκφραση.
Η σειρά δεσμών ενός μορίου μας δίνει ένα μέτρο ή δείκτη της ισχύος των δεσμών που το δεσμεύουν. Οι δεσμοί συνδέουν τα άτομα όπως ένα λαστιχάκι που δένει τα δύο σας χέρια. Ένα διπλό δέσιμο θα σήμαινε ότι το λάστιχο είναι τώρα διπλωμένο στη μέση και δεμένο γύρω από τα χέρια σας. Λόγω της δύναμης αυτού του νέου διπλού δεσμού, τα χέρια σας έχουν πλησιάσει το ένα το άλλο. Το μόριο είναι πλέον πιο σταθερό. Ομοίως, τρεις δεσμοί ή τρεις πτυχές θα έφερναν τα χέρια σας ακόμα πιο κοντά. Επιπλέον, όσο ισχυρότερος είναι ο δεσμός, τόσο περισσότερη ενέργεια απαιτείται για να σπάσει - τα χέρια είναι πολύ πιο εύκολο να ελευθερωθούν όταν δεσμεύονται από ένα μονόπτυχο λάστιχο από ένα διπλό ή τριπλό λάστιχο. Η ενέργεια που απαιτείται για τη διάσπαση του δεσμού αναφέρεται ως ενέργεια του δεσμού των μορίων.




