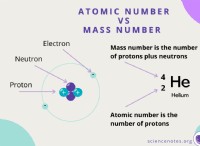
Όσο λιγότερα κέλυφος ηλεκτρονίων είναι η θωράκιση των ηλεκτρονίων από τον πυρήνα.
* Κεφάλαια ηλεκτρονίων: Τα κελύφη ηλεκτρονίων είναι επίπεδα ενέργειας που περιβάλλουν τον πυρήνα ενός ατόμου. Κάθε κέλυφος μπορεί να κρατήσει έναν συγκεκριμένο αριθμό ηλεκτρονίων. Τα κελύφη αριθμούνται διαδοχικά, με το πρώτο κέλυφος (n =1) να είναι πιο κοντά στον πυρήνα και τα επακόλουθα κελύφη περαιτέρω.
* θωράκιση: Η θωράκιση συμβαίνει όταν τα εσωτερικά ηλεκτρόνια (εκείνα σε χαμηλότερα κελύφη ενέργειας) εμποδίζουν την έλξη μεταξύ του πυρήνα και των εξωτερικών ηλεκτρονίων. Όσο πιο εσωτερικά ηλεκτρόνια υπάρχουν, τόσο ισχυρότερο είναι το φαινόμενο θωράκισης.
* Λιγότερα κελύφη, λιγότερη θωράκιση: Όταν ένα άτομο έχει λιγότερα κελύφη ηλεκτρονίων, τα εξωτερικά ηλεκτρόνια είναι πιο κοντά στον πυρήνα. Βιώνουν λιγότερο θωράκιση από εσωτερικά ηλεκτρόνια, οδηγώντας σε ισχυρότερη έλξη στον πυρήνα.
Παράδειγμα:
* λίθιο (li): Έχει 3 ηλεκτρόνια, 2 στο πρώτο κέλυφος και 1 στο δεύτερο. Το ενιαίο εξωτερικό ηλεκτρόνιο βιώνει ελάχιστη θωράκιση από τα 2 εσωτερικά ηλεκτρόνια.
* νάτριο (NA): Έχει 11 ηλεκτρόνια, με 2 στο πρώτο κέλυφος, 8 στο δεύτερο, και 1 στο τρίτο. Το εξωτερικό ηλεκτρόνιο σε νάτριο βιώνει περισσότερη θωράκιση από τα 10 εσωτερικά ηλεκτρόνια.
Βασικές επιπτώσεις:
* ενέργεια ιονισμού: Τα άτομα με λιγότερα κελύφη ηλεκτρονίων τείνουν να έχουν υψηλότερες ενέργειες ιονισμού (η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου). Αυτό οφείλεται στο γεγονός ότι τα εξωτερικά ηλεκτρόνια προσελκύονται περισσότερο από τον πυρήνα.
* Αντιδραστικότητα: Τα στοιχεία με λιγότερα κελύφη ηλεκτρονίων μπορούν να είναι πιο αντιδραστικά, καθώς τα εξωτερικά τους ηλεκτρόνια είναι πιο προσιτά και συμμετέχουν εύκολα στη χημική σύνδεση.
Επιτρέψτε μου να ξέρω αν θέλετε περαιτέρω διευκρίνιση ή παραδείγματα!