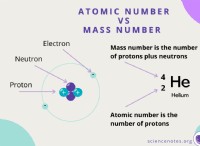
Είναι σταθερό το άτομο υδρογόνου και γιατί;
* Το ηλεκτρόνιο βρίσκεται στο χαμηλότερο επίπεδο ενέργειας: Το ηλεκτρόνιο σε ένα άτομο υδρογόνου καταλαμβάνει το χαμηλότερο επίπεδο ενέργειας, γνωστό ως κατάσταση εδάφους (1s τροχιά). Αυτή η κατάσταση είναι η πιο σταθερή διαμόρφωση για το ηλεκτρόνιο.
* Ηλεκτροστατική έλξη: Το θετικά φορτισμένο πρωτόνιο στον πυρήνα προσελκύει έντονα το αρνητικά φορτισμένο ηλεκτρόνιο. Αυτή η ηλεκτροστατική έλξη συγκρατεί το άτομο μαζί.
* Κβαντική μηχανική: Η κβαντική μηχανική περιγράφει τη συμπεριφορά των ηλεκτρονίων στα άτομα. Το 1S Orbital είναι ένα σφαιρικό σχήμα και το ηλεκτρόνιο "κυματίζεται" μέσα σε αυτό το χώρο. Αυτό σημαίνει ότι το ηλεκτρόνιο δεν περιστρέφεται γύρω από τον πυρήνα με κλασική έννοια, αλλά υπάρχει σε ένα σύννεφο πιθανότητας.
* Δεν υπάρχει περαιτέρω ενέργεια για απελευθέρωση: Για να γίνει πιο σταθερό, το άτομο υδρογόνου θα χρειαστεί να απελευθερώσει ενέργεια. Δεδομένου ότι βρίσκεται ήδη στην κατάσταση του εδάφους, δεν έχει περαιτέρω ενέργεια για απελευθέρωση.
Ωστόσο, είναι σημαντικό να σημειωθεί ότι το άτομο υδρογόνου μπορεί να γίνει ασταθές υπό ορισμένες συνθήκες:
* ιονισμός: Εάν παρέχεται αρκετή ενέργεια, το ηλεκτρόνιο μπορεί να αφαιρεθεί από το άτομο, δημιουργώντας ένα θετικά φορτισμένο ιόν υδρογόνου (Η+).
* διεγερμένες καταστάσεις: Εάν το άτομο απορροφά την ενέργεια (π.χ. από το φως), το ηλεκτρόνιο μπορεί να προωθηθεί σε υψηλότερα επίπεδα ενέργειας (διεγερμένες καταστάσεις). Αυτές οι ενθουσιασμένες καταστάσεις είναι ασταθείς και το ηλεκτρόνιο θα πέσει γρήγορα στην κατάσταση του εδάφους, απελευθερώνοντας την ενέργεια ως φως.
Συνοπτικά: Το άτομο υδρογόνου στην ηλεκτρονική κατάσταση του εδάφους του είναι σταθερό λόγω της ισχυρής ηλεκτροστατικής έλξης μεταξύ του πρωτονίου και του ηλεκτρονίου, της κατοχής του ηλεκτρονίου από το χαμηλότερο επίπεδο ενέργειας και της εγγενούς σταθερότητας αυτής της διαμόρφωσης.