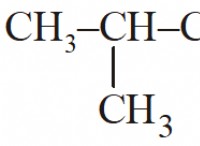Ποια είναι η σημασία της ισοτονικής λύσης στη φαρμακευτική χημεία;
1. Φυσιολογική συμβατότητα:
* ελαχιστοποίηση των κυτταρικών βλάβης: Τα ισοτονικά διαλύματα έχουν την ίδια ωσμωτική πίεση με τα σωματικά υγρά (αίμα, διάμεσο υγρό). Αυτό σημαίνει ότι δεν προκαλούν τη συρρίκνωση των κυττάρων (υπερτονικά) ή διογκών (υποτονικών) όταν χορηγούνται. Αυτό είναι ζωτικής σημασίας για την πρόληψη της βλάβης των κυττάρων, ειδικά κατά τη διάρκεια ενδοφλέβων ενέσεων ή σταγόνων οφθαλμών.
* Διατήρηση οσμωτικής ισορροπίας: Οι ισοτονικές λύσεις συμβάλλουν στη διατήρηση της ευαίσθητης ισορροπίας των υγρών μέσα στο σώμα, εμποδίζοντας την αφυδάτωση ή την υπερεκτίμηση. Αυτό είναι ιδιαίτερα σημαντικό για τους ασθενείς με ανισορροπίες υγρών.
2. Παράδοση και απορρόφηση φαρμάκων:
* Βελτιστοποίηση της απορρόφησης: Τα ισοτονικά διαλύματα διευκολύνουν την αποτελεσματική απορρόφηση των φαρμάκων στην κυκλοφορία του αίματος. Αποτρέπουν τον ερεθισμό και διασφαλίζουν ότι το φάρμακο μπορεί να φτάσει στο χώρο του στόχου του χωρίς να παρεμποδίζεται από διαφορές οσμωτικής πίεσης.
* Αυξημένη σταθερότητα φαρμάκου: Ορισμένα φάρμακα είναι πιο σταθερά σε ισοτονικές λύσεις, οι οποίες βοηθούν στη διατήρηση της θεραπευτικής τους αποτελεσματικότητας με την πάροδο του χρόνου.
3. Άνεση και ασφάλεια του ασθενούς:
* Μειωμένος ερεθισμός: Τα ισοτονικά διαλύματα είναι λιγότερο πιθανό να προκαλέσουν πόνο, τσίμπημα ή ερεθισμό όταν εφαρμόζονται σε ευαίσθητες περιοχές όπως τα μάτια, η μύτη ή οι πληγές.
* Ενισχυμένη ανοχή: Οι ασθενείς είναι πιο πιθανό να ανεχθούν ισοτονικές λύσεις, βελτιώνοντας τη συμμόρφωσή τους με τα φάρμακα.
4. Σκέψεις διαμόρφωσης:
* Διαλυτότητα φαρμάκων: Οι ισοτονικές λύσεις μπορούν να βοηθήσουν στη διάλυση φαρμάκων που είναι κακώς διαλυτά στο νερό, βελτιώνοντας τη βιοδιαθεσιμότητά τους.
* Διατήρηση: Οι ισοτονικές λύσεις μπορούν να διαμορφωθούν ώστε να περιλαμβάνουν συντηρητικά, τα οποία βοηθούν στην επέκταση της διάρκειας ζωής του φαρμάκου.
Παραδείγματα ισοτονικών λύσεων στη φαρμακευτική χημεία:
* Ενδοφλέβια υγρά: Το διάλυμα αλατούχου διάλυμα (0,9% NaCl) και το γαλακτικό διάλυμα Ringer είναι παραδείγματα ισοτονικών ρευστών IV που χρησιμοποιούνται για την αντικατάσταση ενυδάτωσης και ηλεκτρολύτη.
* οφθαλμικές σταγόνες: Πολλές οφθαλμικές σταγόνες είναι διαμορφωμένες για να είναι ισοτονικές με τα δάκρυα για να αποφευχθεί ο ερεθισμός και να προωθήσουν την απορρόφηση.
* ρινικά σπρέι: Τα ισοτονικά ρινικά σπρέι χρησιμοποιούνται για την ανακούφιση της συμφόρησης και την αποτελεσματική παράδοση φαρμάκων.
* Ενέσιμα φάρμακα: Πολλά φάρμακα ενέσιμα, όπως η ινσουλίνη και τα αντιβιοτικά, διατυπώνονται ως ισοτονικές λύσεις.
Συμπέρασμα:
Οι ισοτονικές λύσεις διαδραματίζουν κρίσιμο ρόλο στη φαρμακευτική χημεία εξασφαλίζοντας τη φυσιολογική συμβατότητα, τη βελτιστοποίηση της χορήγησης φαρμάκων, την ενίσχυση της άνεσης και της ασφάλειας των ασθενών και τη διευκόλυνση της διαμόρφωσης αποτελεσματικών και σταθερών φαρμακευτικών προϊόντων.