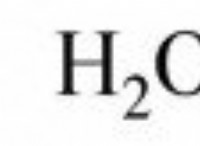Τι σημαίνει ιοντικός και ομοιοπολικός στη χημεία;
Ιωνικοί και ομοιοπολικοί δεσμοί:Οι δύο κύριοι τρόποι με τα άτομα Bond
Στη χημεία, τα άτομα συνδέονται μαζί για να σχηματίσουν μόρια. Αυτή η συγκόλληση συμβαίνει επειδή τα άτομα θέλουν να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων, που συνήθως μοιάζουν με τα ευγενή αέρια, τα οποία είναι εξαιρετικά αντιδραστικά. Υπάρχουν δύο κύριοι τύποι χημικών δεσμών:
1. Ιωνικοί δεσμοί:
* Ορισμός: Ένας ιοντικός δεσμός σχηματίζεται μεταξύ δύο ατόμων όταν ένα άτομο πλήρως μεταφορές ένα ηλεκτρόνιο στο άλλο άτομο. Αυτή η μεταφορά δημιουργεί ιόντα , τα οποία χρεώνονται άτομα ή ομάδες ατόμων.
* σχηματισμός: Αυτό συμβαίνει μεταξύ ενός μετάλλου (τείνει να χάσει ηλεκτρόνια) και ένα μη μέταλλο (τείνει να κερδίσει ηλεκτρόνια).
* Χαρακτηριστικά:
* Ισχυρή ηλεκτροστατική έλξη μεταξύ αντιθέτων φορτισμένων ιόντων.
* Υψηλά σημεία τήξης και βρασμού λόγω ισχυρής έλξης.
* Συνήθως σχηματίζουν στερεές κρυσταλλικές δομές σε θερμοκρασία δωματίου.
* Καλοί αγωγοί ηλεκτρικής ενέργειας όταν διαλύονται σε νερό ή λιωμένο.
* Παραδείγματα: NaCl (αλάτι τραπεζιού), MGO (οξείδιο μαγνησίου), KBR (βρωμιούχο κάλιο)
2. Ομοιοπολικοί δεσμοί:
* Ορισμός: Ένας ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται ηλεκτρόνια για την επίτευξη σταθερής διαμόρφωσης ηλεκτρονίων.
* σχηματισμός: Συνήθως εμφανίζεται μεταξύ δύο μη μεταλλικών.
* Χαρακτηριστικά:
* Σχετικά ασθενέστερα από ιοντικά δεσμούς.
* Μπορεί να είναι ανύπαντρη, διπλά ή τριπλά ομόλογα ανάλογα με τον αριθμό των κοινόχρηστων ηλεκτρονίων.
* Μπορεί να σχηματίσει τόσο στερεά, υγρά όσο και αέρια μόρια σε θερμοκρασία δωματίου.
* Συνήθως κακοί αγωγοί ηλεκτρικής ενέργειας.
* Παραδείγματα: H₂o (νερό), CO₂ (διοξείδιο του άνθρακα), ch₄ (μεθάνιο)
Συνοπτικά:
| Χαρακτηριστικό | Ιωνικοί δεσμοί | Ομοιοπολικοί δεσμοί |
| --- | --- | --- |
| Μεταφορά ηλεκτρονίων/κοινή χρήση | Μεταφορά | Κοινή χρήση |
| μέταλλο/μη μεταλλικό | Metal &Non-Metal | Μη μεταλλικό &μη μεταλλικό |
| δύναμη | Ισχυρή | Ασθενέστερος |
| σημεία τήξης/βρασμού | Υψηλή | Κατώτερο |
| αγωγιμότητα | Καλό (όταν διαλύεται ή λιώνει) Κακή |
Θυμηθείτε ότι η διάκριση μεταξύ ιοντικών και ομοιοπολικών δεσμών δεν είναι πάντα σαφής. Ορισμένες ενώσεις έχουν χαρακτηριστικά και των δύο τύπων δεσμών και αυτό ονομάζεται πολική ομοιοπολική σύνδεση .