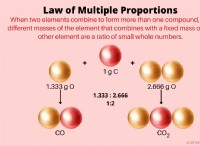
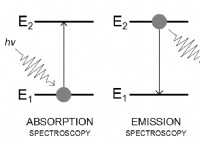
Οι πολικοί ομοιοπολικοί δεσμοί έχουν χαμηλότερο ή υψηλότερο ηλεκτροαρνητικό;
Εδώ είναι γιατί:
* Ηλεκτροργατιστικότητα: Αυτό είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του σε χημικό δεσμό.
* πολικός ομοιοπολικός δεσμός: Σε αυτόν τον τύπο δεσμού, τα ηλεκτρόνια μοιράζονται άνισα μεταξύ των δύο ατόμων. Ένα άτομο προσελκύει τα κοινά ηλεκτρόνια πιο έντονα, με αποτέλεσμα ένα μερικό αρνητικό φορτίο σε αυτό το άτομο και ένα μερικό θετικό φορτίο στο άλλο άτομο.
Παράδειγμα: Σε ένα μόριο νερού (H₂O), το οξυγόνο έχει υψηλότερη ηλεκτροαρνητικότητα από το υδρογόνο. Αυτό σημαίνει ότι το άτομο οξυγόνου προσελκύει τα κοινά ηλεκτρόνια πιο έντονα, δημιουργώντας ένα μερικό αρνητικό φορτίο στο οξυγόνο και ένα μερικό θετικό φορτίο στα άτομα υδρογόνου. Αυτή η άνιση κατανομή των ηλεκτρονίων οδηγεί στην πολική φύση του μορίου νερού.
Συνοπτικά:
* Υψηλότερη διαφορά ηλεκτροαρνητικότητας: Οδηγεί σε έναν πιο πολικό ομοιοπολικό δεσμό.
* Κάτω διαφορά ηλεκτροαρνητικότητας: Οδηγεί σε λιγότερο πολικό ομοιοπολικό δεσμό ή ακόμα και σε μη πολικό ομοιοπολικό δεσμό (όταν η διαφορά ηλεκτροαρνητικότητας είναι πολύ μικρή).