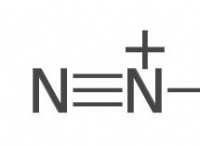
Όταν ένα μεταλλικό άτομο συνδυάζεται με τη μη μέταλλο η θέληση;
* μέταλλα τείνουν να χάσουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων. Γίνονται θετικά φορτισμένα ιόντα (κατιόντα).
* Μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων. Γίνονται αρνητικά φορτισμένα ιόντα (ανιόντα).
Η ισχυρή ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων είναι αυτό που αποτελεί ιοντικό δεσμό. Αυτό το αξιοθέατο συγκρατεί τα άτομα μαζί σε δομή κρυσταλλικού πλέγματος.
Παράδειγμα:
Το νάτριο (Na) είναι ένα μέταλλο που χάνει εύκολα ένα ηλεκτρόνιο για να σχηματίσει ένα κατιόν Na+. Το χλώριο (CL) είναι ένα μη μέταλλο που κερδίζει εύκολα ένα ηλεκτρόνιο για να σχηματίσει ένα cl-ανιόν. Όταν συνδυάζονται, σχηματίζουν χλωριούχο νάτριο (NaCl), κοινώς γνωστό ως επιτραπέζιο αλάτι.
Βασικά σημεία:
* Οι ιοντικοί δεσμοί συνήθως σχηματίζονται μεταξύ στοιχείων με μεγάλες διαφορές στην ηλεκτροαρνητικότητα.
* Οι ιοντικές ενώσεις είναι γενικά στερεές σε θερμοκρασία δωματίου και έχουν υψηλά σημεία τήξης.
* Είναι καλοί αγωγοί ηλεκτρικής ενέργειας όταν διαλύονται σε νερό ή λιωμένο.