Διαφορά μεταξύ βαρέος και κανονικού νερού
Κύρια διαφορά – Βαρύ νερό έναντι Κανονικού Νερού
Περίπου το 71% του φλοιού της γης καλύπτεται με νερό, αλλά ένα πολύ μικρό ποσοστό του είναι πόσιμο. Το νερό είναι απαραίτητο συστατικό για όλα τα έμβια όντα στην καθημερινή τους ζωή. Τα ζωντανά όντα δεν μπορούν να επιβιώσουν χωρίς νερό. Η παρουσία του νερού είναι ο κύριος λόγος για τον οποίο υπάρχει ζωή στη γη. Το κανονικό νερό αποτελείται από H2 Μόρια O, τα οποία ονομάζονται μόριο νερού. Αλλά υπάρχει ένα άλλο είδος νερού που ονομάζεται βαρύ νερό. Η κύρια διαφορά μεταξύ βαρέος και κανονικού νερού είναι ότι το βαρύ νερό αποτελείται από d2 o μόρια ενώ το κανονικό νερό αποτελείται από h2 o μόρια.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Βαρύ Νερό
– Ορισμός, Ιδιότητες, Χρήσεις
2. Τι είναι το Κανονικό Νερό
– Ορισμός, Ιδιότητες, Χρήσεις
3. Ποιες είναι οι ομοιότητες ανάμεσα στο βαρύ νερό και το κανονικό νερό
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά ανάμεσα στο βαρύ νερό και το κανονικό νερό
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Δευτέριο, Βαρύ Νερό, Υδρογόνο, Κανονικό Νερό, Πρωτίου 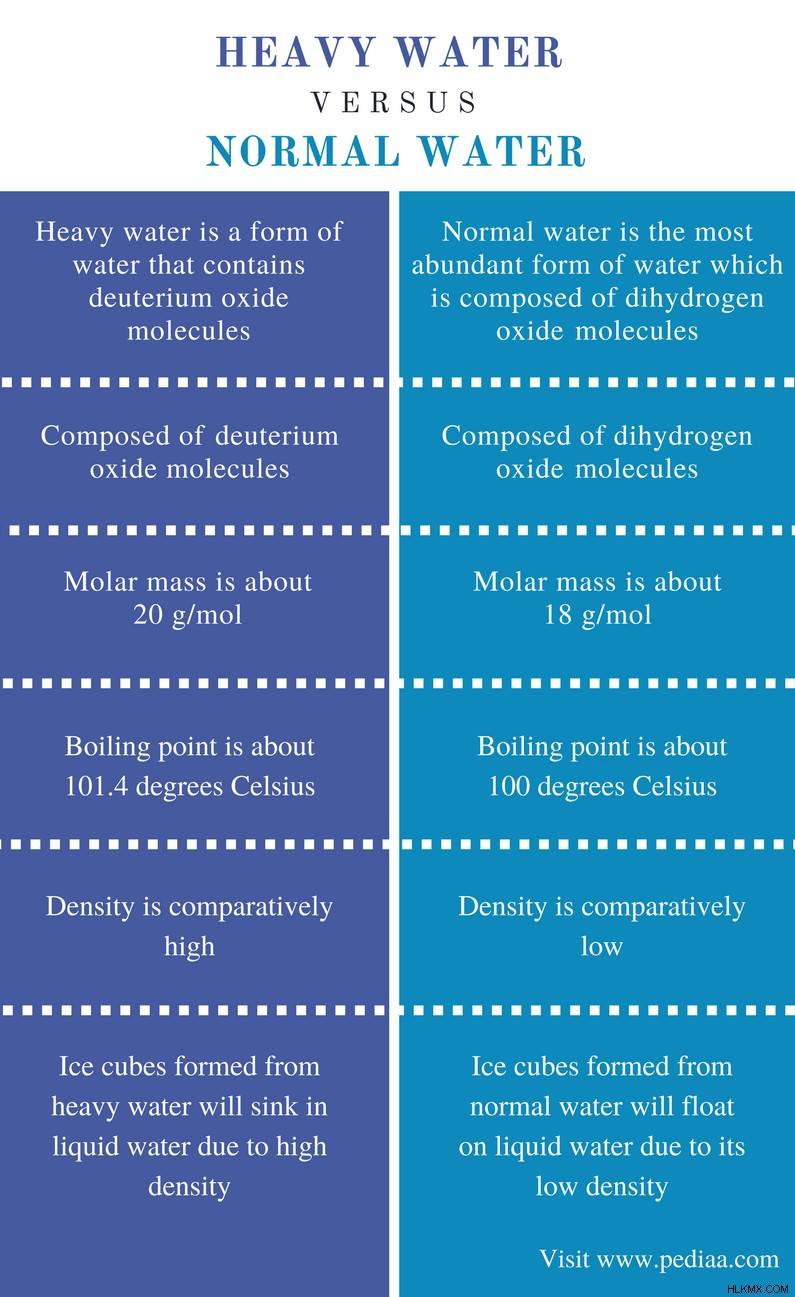
Τι είναι το Heavy Water
Το βαρύ νερό είναι μια μορφή νερού που περιέχει D2 Ω μόρια. Αυτά τα D2 Τα μόρια O αποτελούνται από άτομα δευτερίου και άτομα οξυγόνου. Κανονικά, το νερό αποτελείται από H2 Ω μόρια. Ο λόγος για το όνομα "Βαρύ νερό" είναι ότι το Δευτέριο (D) είναι βαρύτερο από το Υδρογόνο (Η) που υπάρχει στο κανονικό νερό.
Δευτέριο είναι ισότοπο του Υδρογόνου. Αποτελείται από ένα νετρόνιο και ένα πρωτόνιο στον πυρήνα του. Επομένως, η ατομική μάζα του δευτερίου είναι 2,014 amu. Αυτό συμβαίνει επειδή η ατομική μάζα είναι το άθροισμα του αριθμού των νετρονίων και των πρωτονίων. Ωστόσο, αποτελείται από ένα ηλεκτρόνιο, ακριβώς όπως το άτομο υδρογόνου.
Σε αντίθεση με το υδρογόνο, το δευτέριο είναι λιγότερο άφθονο στη γη. Η αφθονία του είναι περίπου 0,015%. Το D2 Το μόριο O έχει γωνιακή γεωμετρία. Η μοριακή μάζα του D2 Το Ο είναι περίπου 20 g/mol. Η πυκνότητα του βαρέος νερού είναι περίπου 1,107 g/mL. Το σημείο βρασμού του βαρέος νερού είναι 101,4 C. Το βαρύ νερό αναμιγνύεται πλήρως με το νερό.
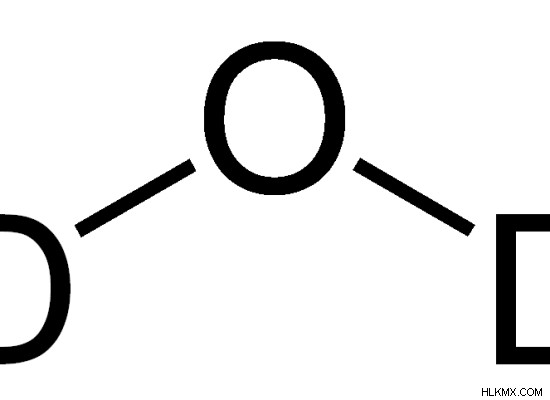
Εικόνα 1:Η χημική δομή του D2 Ο
Μπορεί να υπάρχουν και άλλοι τύποι βαρέων και ημιβαρέων υδάτων. Για παράδειγμα, το ημιβαρύ νερό αποτελείται από μόρια HDO. Αυτό αποτελείται από ένα άτομο υδρογόνου, ένα άτομο δευτερίου και ένα άτομο οξυγόνου. Εάν όχι, μπορεί να υπάρχει βαρύ νερό οξυγόνου. Αυτό σημαίνει ότι αυτό το βαρύ νερό αποτελείται από μόρια νερού που αποτελούνται από άτομα υδρογόνου και βαρέα ισότοπα οξυγόνου.
Υπάρχουν πολλές εφαρμογές του βαρέος νερού. Το βαρύ νερό χρησιμοποιείται ως πηγή δευτερίου για την παραγωγή διαφορετικών οργανικών ενώσεων.
Τι είναι το Κανονικό Νερό
Το κανονικό νερό είναι η πιο άφθονη μορφή νερού που αποτελείται από H2 Ω μόρια. Αυτός ο τύπος νερού αποτελείται από H2 O μόρια που αποτελούνται από πρώτιο άτομα που είναι τα συνηθέστερα και πιο σταθερά ισότοπα υδρογόνου.
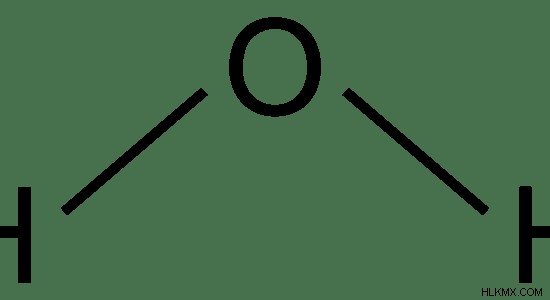
Εικόνα 2:Η χημική δομή του H2 Ο
Το Protium αποτελείται από ένα πρωτόνιο. δεν υπάρχουν νετρόνια. Έχει επίσης ένα μόνο ηλεκτρόνιο. Η αφθονία του πρωτίου στη γη είναι περίπου 99%. Η ατομική μάζα του πρωτίου είναι περίπου 1,00794 amu. Θεωρείται ως το κανονικό υδρογόνο αφού είναι η πιο άφθονη μορφή στη γη.
Η μοριακή μάζα του κανονικού νερού είναι περίπου 18 g/mol. Το σημείο βρασμού του είναι 100C. Κάτω από τους 0 C, το κανονικό νερό υπάρχει σε στερεή μορφή ως πάγος. Πάνω από το σημείο βρασμού του, τα μόρια του νερού υπάρχουν στην αέρια φάση ως ατμός. Υπάρχει μια σειρά από μοναδικές ιδιότητες του νερού που το καθιστούν απαραίτητο συστατικό της ζωής. Τέτοιες ιδιότητες περιλαμβάνουν την επιφανειακή τάση, την ικανότητα σχηματισμού ισχυρών δεσμών υδρογόνου κ.λπ.
Ομοιότητες μεταξύ Heavy Water και Normal Water
- Τόσο το βαρύ όσο και το κανονικό νερό αποτελούνται από ισότοπα υδρογόνου.
- Και τα δύο αποτελούνται από άτομα οξυγόνου.
- Και τα δύο είναι υγρά σε θερμοκρασία δωματίου.
- Και τα δύο είναι άοσμα και άχρωμα υγρά.
Διαφορά μεταξύ Βαρύ Νερού και Κανονικού Νερού
Ορισμός
Βαρύ νερό: Το βαρύ νερό είναι μια μορφή νερού που περιέχει D2 O μόρια.
Κανονικό νερό: Το κανονικό νερό είναι η πιο άφθονη μορφή νερού που αποτελείται από H2 O μόρια.
Μόρια
Βαρύ νερό: Το βαρύ νερό αποτελείται από D2 O μόρια.
Κανονικό νερό: Το κανονικό νερό αποτελείται από H2 O μόρια.
Μοριακή μάζα
Βαρύ νερό: Η μοριακή μάζα του βαρέος νερού είναι περίπου 20 g/mol.
Κανονικό νερό: Η μοριακή μάζα του κανονικού νερού είναι περίπου 18 g/mol.
Σημείο βρασμού
Βαρύ νερό: Το σημείο βρασμού του βαρέος νερού είναι περίπου 101,4 C.
Κανονικό νερό: Το σημείο βρασμού του κανονικού νερού είναι 100 C.
Πυκνότητα
Βαρύ νερό: Η πυκνότητα του βαρέος νερού είναι συγκριτικά υψηλή.
Κανονικό νερό: Η πυκνότητα του κανονικού νερού είναι συγκριτικά μικρότερη.
Πάγος
Βαρύ νερό: Τα παγάκια που σχηματίζονται από βαρύ νερό θα βυθιστούν σε υγρό νερό λόγω της υψηλής πυκνότητας.
Κανονικό νερό: Τα παγάκια που σχηματίζονται από κανονικό νερό θα επιπλέουν σε υγρό νερό λόγω της χαμηλής πυκνότητάς του.
Συμπέρασμα
Αν και το βαρύ νερό και το κανονικό νερό είναι δύο μορφές νερού, το κανονικό νερό χρησιμοποιείται κυρίως στις καθημερινές ανάγκες. Αυτό συμβαίνει επειδή το σώμα δεν μπορεί να συγκρατήσει μεγάλη ποσότητα βαρέος νερού λόγω του υψηλού βάρους και της πυκνότητάς του. Αυτή είναι μια σημαντική διαφορά μεταξύ βαρέος και κανονικού νερού. Το βαρύ νερό χρησιμοποιείται σε ορισμένες διαδικασίες σύνθεσης όπου απαιτείται πηγή δευτερίου.




