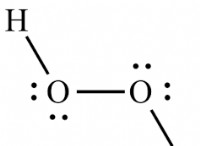
Πώς διαφέρουν οι λύσεις στο νερό μοριακών ενώσεων και ιοντικών;
Μοριακές ενώσεις
* Διάλυση: Οι μοριακές ενώσεις διαλύονται τυπικά στο νερό σχηματίζοντας δεσμούς υδρογόνου με μόρια νερού. Αυτοί οι δεσμοί είναι ασθενέστεροι από τους ιοντικούς δεσμούς σε ιοντικές ενώσεις.
* αγωγιμότητα: Τα διαλύματα μοριακών ενώσεων είναι γενικά κακοί αγωγοί ηλεκτρικής ενέργειας . Αυτό οφείλεται στο γεγονός ότι τα ίδια τα μόρια δεν διαχωρίζονται σε φορτισμένα ιόντα όταν διαλύονται.
* Παραδείγματα: Ζάχαρη (σακχαρόζη), αιθανόλη (αλκοόλ), γλυκόζη
Ιωνικές ενώσεις
* Διάλυση: Οι ιοντικές ενώσεις διαλύονται στο νερό επειδή τα μόρια του νερού έχουν μια πολική δομή (θετικά και αρνητικά άκρα). Τα θετικά άκρα των μορίων του νερού προσελκύουν τα αρνητικά ιόντα στην ιοντική ένωση και τα αρνητικά άκρα προσελκύουν τα θετικά ιόντα. Αυτή η διαδικασία ονομάζεται διάσπαση , όπου η ιοντική ένωση διασπάται στα μεμονωμένα ιόντα της.
* αγωγιμότητα: Τα διαλύματα ιοντικών ενώσεων είναι καλοί αγωγοί ηλεκτρικής ενέργειας . Αυτό οφείλεται στο γεγονός ότι τα διαλυμένα ιόντα μπορούν να κινούνται ελεύθερα στο διάλυμα και να φέρουν ένα ηλεκτρικό ρεύμα.
* Παραδείγματα: Πίνακας αλάτι (NaCl), χλωριούχο κάλιο (KCL), υδροξείδιο νατρίου (NaOH)
Βασικές διαφορές:
* Διάσπαση: Οι ιοντικές ενώσεις διαχωρίζονται σε ιόντα στο νερό, ενώ οι μοριακές ενώσεις γενικά δεν το κάνουν.
* αγωγιμότητα: Τα ιοντικά διαλύματα είναι αγώγιμα, ενώ τα μοριακά διαλύματα δεν είναι συνήθως.
* Τύποι ομολόγων: Οι μοριακές ενώσεις διαλύονται μέσω δεσμού υδρογόνου, ενώ οι ιοντικές ενώσεις διαλύονται μέσω ηλεκτροστατικών αλληλεπιδράσεων.
Εξαιρέσεις:
* Ορισμένες μοριακές ενώσεις μπορούν να ιονίζουν ελαφρώς στο νερό, καθιστώντας τους αδύναμους αγωγούς ηλεκτρικής ενέργειας. Παραδείγματα περιλαμβάνουν οξικό οξύ (ξύδι) και αμμωνία.
* Δεν διαλύονται εύκολα όλες οι ιοντικές ενώσεις στο νερό. Ορισμένες ιοντικές ενώσεις, όπως το χλωριούχο ασήμι (AGCL), έχουν πολύ χαμηλή διαλυτότητα στο νερό.
Συνοπτικά:
Ο τρόπος με τον οποίο μια ένωση συμπεριφέρεται όταν διαλύεται στο νερό εξαρτάται από τη χημική του δομή και τον τύπο σύνδεσης που υπάρχει. Οι ιοντικές ενώσεις διαχωρίζουν και σχηματίζουν αγώγιμα διαλύματα, ενώ οι μοριακές ενώσεις συνήθως δεν το κάνουν.