Κατά τη σύγκριση της αντοχής των δεσμών μεταξύ των μορίων ιοντικών έχουν τι και μοριακοί δεσμοί;
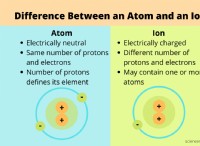
Ιονικά ομόλογα:
* Ισχυρά ηλεκτροστατικά αξιοθέατα: Οι ιοντικοί δεσμοί σχηματίζονται με τη μεταφορά ηλεκτρονίων μεταξύ των ατόμων, δημιουργώντας θετικά φορτισμένα ιόντα (κατιόντα) και αρνητικά φορτισμένα ιόντα (ανιόντα). Αυτές οι αντίθετες χρεώσεις προσελκύουν έντονα, οδηγώντας σε έναν πολύ ισχυρό δεσμό.
* υψηλά σημεία τήξης και βρασμού: Λόγω της ισχυρής ηλεκτροστατικής έλξης, οι ιοντικές ενώσεις συνήθως έχουν υψηλά σημεία τήξης και βρασμού.
* Διαλυτότητα: Οι ιοντικές ενώσεις είναι συχνά διαλυτές σε πολικούς διαλύτες όπως το νερό επειδή τα μόρια του νερού μπορούν να αλληλεπιδρούν με τα φορτισμένα ιόντα, σπάζοντας το ιοντικό πλέγμα.
* αγωγιμότητα: Οι ιοντικές ενώσεις διεξάγουν ηλεκτρική ενέργεια όταν διαλύονται σε νερό ή λιωμένες επειδή τα ιόντα είναι ελεύθερα να κινηθούν.
Μοριακοί δεσμοί (ομοιοπολικοί δεσμοί):
* Κοινή χρήση ηλεκτρονίων: Οι ομοιοπολικοί δεσμοί σχηματίζονται από την κατανομή ηλεκτρονίων μεταξύ των ατόμων.
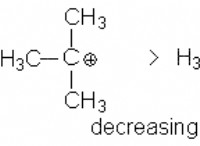
* μεταβαλλόμενη δύναμη δεσμού: Η αντοχή ενός ομοιοπολικού δεσμού εξαρτάται από τον τύπο των εμπλεκόμενων ατόμων και πόσα ηλεκτρόνια μοιράζονται (μονό, διπλό ή τριπλό δεσμό).
* χαμηλότερα σημεία τήξης και βρασμού: Σε σύγκριση με τις ιοντικές ενώσεις, οι μοριακές ενώσεις έχουν χαμηλότερα σημεία τήξης και βρασμού επειδή οι ομοιοπολικοί δεσμοί είναι γενικά ασθενέστεροι.
* Διαλυτότητα: Οι μοριακές ενώσεις μπορούν να διαλυτούν σε μη πολικούς διαλύτες (όπως το έλαιο) ή στους πολικούς διαλύτες (όπως το νερό), ανάλογα με την πολικότητα των μορίων.
* αγωγιμότητα: Οι μοριακές ενώσεις συνήθως δεν διεξάγουν ηλεκτρική ενέργεια επειδή τα ηλεκτρόνια τους εντοπίζονται εντός των δεσμών και δεν είναι ελεύθεροι να κινούνται.
Συνοπτικά:
Οι ιοντικοί δεσμοί είναι γενικά ισχυρότεροι από τους μοριακούς δεσμούς επειδή περιλαμβάνουν την ισχυρή έλξη των αντιθέτων φορτισμένων ιόντων. Αυτό έχει ως αποτέλεσμα ιοντικές ενώσεις που έχουν υψηλότερα σημεία τήξης, σημεία βρασμού και συχνά είναι πιο διαλυτές στο νερό.