Μέτρηση της σταθερότητας των μορίων με το επαγωγικό φαινόμενο
Το επαγωγικό φαινόμενο, γνωστό και ως εφέ I, είναι ένα φαινόμενο που εξαρτάται από την απόσταση. Σε αυτό το φαινόμενο, το φορτίο ενός χημικού δεσμού επηρεάζει τον προσανατολισμό των γειτονικών δεσμών σε ένα μόριο, με αποτέλεσμα μια μόνιμη κατάσταση πόλωσης. Αυτό το άρθρο έχει μετρήσει τη σταθερότητα των μορίων με το επαγωγικό αποτέλεσμα (Λυμένο Παράδειγμα). Επίσης, επεξεργάζεται τη μέτρηση της σταθερότητας των μορίων με το επαγωγικό αποτέλεσμα (λυμένο παράδειγμα) που σημαίνει και τη μέτρηση της σταθερότητας των μορίων με τη σημασία του επαγωγικού αποτελέσματος (Λυμένο Παράδειγμα).
Πώς λειτουργεί το εφέ;
Όταν μόρια από δύο ή περισσότερα στοιχεία εμπλέκονται σε έναν δεσμό, η πυκνότητα ηλεκτρονίων του δεσμού δεν είναι ομοιόμορφη . Τα νέφη ηλεκτρονίων σε έναν δεσμό τείνουν να έλκονται προς το πιο ηλεκτραρνητικό άτομο του δεσμού.
Στα μόρια του νερού, εμφανίζεται μια επαγωγική επίδραση. Οι χημικοί δεσμοί ενός μορίου νερού είναι πιο θετικά φορτισμένοι κοντά στα άτομα υδρογόνου και πολύ πιο αρνητικά φορτισμένοι προς τα άτομα οξυγόνου. Τα μόρια του νερού, ως αποτέλεσμα, είναι πολικά. Ωστόσο, επειδή το επαγόμενο φορτίο είναι μικρό και το επαγωγικό αποτέλεσμα είναι αποτελεσματικό μόνο σε μικρές αποστάσεις, μπορεί να ξεπεραστεί γρήγορα από άλλους παράγοντες.
Τύποι επαγωγικών εφέ
+Εφέ I
Το φαινόμενο +I συμβαίνει όταν ένα άτομο ή ομάδα συνεισφέρει ηλεκτρόνια σε έναν δεσμό και αποκτά μερικό θετικό φορτίο , αναφέρεται ως ομάδα +I και το αποτέλεσμα είναι γνωστό ως θετικό επαγωγικό αποτέλεσμα ή εφέ +I.
Το εφέ +I λαμβάνει χώρα στις ακόλουθες ομάδες:– O –, – COO –, –CR3 , –CHR2, –CH2R, –CH3, –D
-Εφέ
Μπορείτε να πείτε ότι το φαινόμενο -I λαμβάνει χώρα όταν ένα άτομο ή ομάδα προσελκύει συνδετικά ηλεκτρόνια στον εαυτό του και αναπτύσσεται ένα ελαφρύ αρνητικό φορτίο. Αναφέρεται ως ομάδα -I και το αντίστοιχο αποτέλεσμα αναφέρεται ως επαγωγικό φαινόμενο απόσυρσης ηλεκτρονίων ή φαινόμενο -I.
Το φαινόμενο -I λαμβάνει χώρα στις ακόλουθες ομάδες:–NO2, – SO2R, –CN, – SO2Ar, –COOH, –F, – Cl, – Br, – I, –OAr, –COOR, –OR, –COR, –SH, –SR, –OH, –Ar, – CH =CR2
Μέτρηση της σταθερότητας των μορίων με το επαγωγικό φαινόμενο (Λυμένο Παράδειγμα)
Ερώτηση 1
Εξηγήστε τη σταθερότητα χρησιμοποιώντας το επαγωγικό αποτέλεσμα του αναφερόμενου σχήματος.
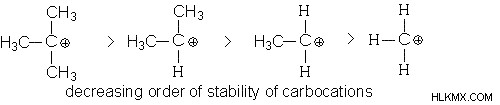
Λύση:
Η σειρά σταθερότητας μπορεί να δοθεί ως:
Τριτοβάθμια> Δευτερεύουσα> Πρωτεύουσα
Το θετικό φορτίο μοιράζεται από τρεις αλκυλομάδες που περιβάλλουν τον άνθρακα στο τριτοταγές καρβοκατιόν. Αυτές οι ομάδες, μέσω του συλλογικού επαγωγικού τους αποτελέσματος (+Ι), εξουδετερώνουν σε κάποιο βαθμό το θετικό φορτίο, προσπαθώντας έτσι να το σταθεροποιήσουν. Το δευτερεύον έχει δύο ομάδες αλκυλίου και το πρωτογενές έχει μία (ή καμία), γεγονός που ευθύνεται για τη φθίνουσα σταθερότητά τους.
Ερώτηση 2
Ποιο από τα παρακάτω εμφανίζει θετικό(+) επαγωγικό αποτέλεσμα;
NO2
–OCH3
–COOH
–CH3
Λύση:
Το
-CH3 δείχνει ένα θετικό επαγωγικό αποτέλεσμα.
Ερώτηση 3
Προσδιορίστε εάν οι παρακάτω προτάσεις είναι σωστές ή λάθος.
Το φαινόμενο –I υπάρχει σε όλες τις αλκυλομάδες.
Η ικανότητα ενός ατόμου ή μιας ομάδας ατόμων να προκαλεί πόλωση της πυκνότητας φορτίου μαζί με έναν ομοιοπολικό δεσμό προκαλεί έλλειψη ηλεκτρονίων στο άτομο με υψηλότερη ηλεκτραρνητικότητα.
Η ομάδα –OH δεν έχει επαγωγικό αποτέλεσμα.
Λύση:
Αλήθεια. Το φαινόμενο +I υπάρχει σε όλες τις αλκυλομάδες. Η πυκνότητα ηλεκτρονίων μιας αλκυλομάδας ωθείται μακριά από τον εαυτό της και προς τον άνθρακα στον οποίο είναι συνδεδεμένη.
Λάθος. Το επαγωγικό αποτέλεσμα είναι η τάση ενός σωματιδίου ή πολλών ατόμων να προκαλούν πόλωση της πυκνότητας φορτίου μαζί με έναν ομοιοπολικό δεσμό, αλλά το άτομο με υψηλότερη ηλεκτραρνητικότητα αποκτά ελαφρώς μεγαλύτερη πυκνότητα ηλεκτρονίων και στη συνέχεια γίνεται ö-.
Λάθος. Όταν μια ομάδα ΟΗ συνδέεται με έναν άνθρακα sp2, μπορεί να εμφανίσει ένα μεσομερικό αποτέλεσμα μέσω της δωρεάς μοναχικού ζεύγους, ενώ το οξυγόνο μπορεί να εμφανίσει επαγωγικό αποτέλεσμα λόγω της υψηλότερης ηλεκτραρνητικότητάς του. Ωστόσο, όταν υπάρχει, το μεσομερικό φαινόμενο είναι κυρίαρχο.
Αλήθεια. Η διπολική ροπή ορίζεται ως το φορτίο πολλαπλασιαζόμενο με την απόσταση μεταξύ των φορτίων. Επειδή το επαγωγικό φαινόμενο προκαλεί διαχωρισμό φορτίου, υπάρχει η διπολική ροπή. Ωστόσο, υπάρχουν παραδείγματα μορίων με διαχωρισμό φορτίου σε δεσμό αλλά διπολική ροπή καθαρού μηδέν λόγω ακύρωσης που προκαλείται από συμμετρία.
Ερώτηση 4
Η σταθερότητα του καρβοκατιόντος καθορίζεται από την επαγωγική επίδραση απελευθέρωσης ηλεκτρονίων ομάδων που γειτνιάζουν με άτομα θετικού φορτίου, επίσης καθώς η συμμετοχή παρακείμενων ομάδων στην υπερσύζευξη και τον συντονισμό. Ποιο από τα αναφερόμενα ιόντα έχει την υψηλότερη σταθερότητα;
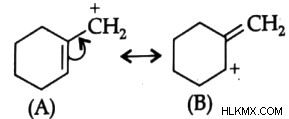
Λύση:
Το καρβοκατιόν (Α) είναι πιο σταθερή ένωση από το καρβοκατιόν (Β) (Β). Επειδή το καρβοκατιόν (Α) είναι πιο επίπεδο, σταθεροποιείται με συντονισμό, ενώ το καρβοκατιόν (Β) είναι μη επίπεδο και επομένως δεν υφίσταται συντονισμό. Επιπλέον, οι διπλοί δεσμοί είναι πιο σταθεροί μέσα στον δακτύλιο παρά έξω από τον δακτύλιο.
Ερώτηση 5
Ποια ένωση έχει πιο επαγωγικό αποτέλεσμα, -OH ή -OR;
Λύση
-OR έχει μεγαλύτερη επίδραση -I παρά -OH. Η κύρια αιτία του φαινομένου -I είναι η διαφορά ηλεκτραρνητικότητας.
Συμπέρασμα
Αυτό το άρθρο σας παρέχει πληροφορίες σχετικά με τη μέτρηση της σταθερότητας των μορίων με το επαγωγικό φαινόμενο (Λυμένο Παράδειγμα). Το επαγωγικό επηρεάζει τη σταθερότητα καθώς και την οξύτητα ή τη βασικότητα ενός χημικού είδους. Τα μόρια με αρνητικά επαγωγικά αποτελέσματα μειώνουν την πυκνότητα των ηλεκτρονίων, καθιστώντας την πιο ανεπάρκεια ηλεκτρονίων και όξινη.