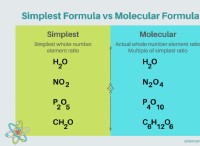
Ποια ιδιότητα καθορίζει εάν ένα άτομο μορφοποιεί ιονικό πολικό συνολικό ή μη πολικό δεσμό;
* Ιονικά ομόλογα: Εμφανίζονται όταν η διαφορά ηλεκτροαρνητικότητας είναι μεγάλη (συνήθως μεγαλύτερη από 1,7). Αυτό σημαίνει ότι ένα άτομο έχει μια ισχυρή έλξη για τα ηλεκτρόνια, ενώ το άλλο έχει μια αδύναμη έλξη. Το αποτέλεσμα είναι μια πλήρης μεταφορά ηλεκτρονίων, σχηματίζοντας ιόντα με αντίθετες χρεώσεις που προσελκύουν ο ένας τον άλλον.
* πολικοί ομοιοπολικοί δεσμοί: Εμφανίζονται όταν η διαφορά ηλεκτροαρνητικότητας είναι μέτρια (μεταξύ 0,4 και 1,7). Αυτό σημαίνει ότι υπάρχει μια ανομοιογενή κοινή χρήση ηλεκτρονίων, που οδηγεί σε μερική θετική φόρτιση σε ένα άτομο και μερικό αρνητικό φορτίο από την άλλη. Αυτό δημιουργεί ένα πολικό μόριο με μια διπολική στιγμή.
* μη πολικά ομοιοπολικά ομόλογα: Εμφανίζονται όταν η διαφορά ηλεκτροαρνητικότητας είναι μικρή (λιγότερο από 0,4). Αυτό σημαίνει ότι τα ηλεκτρόνια μοιράζονται σχεδόν εξίσου μεταξύ των δύο ατόμων, με αποτέλεσμα ένα ουδέτερο μόριο.
Συνοπτικά:
| Τύπος ομολόγων | Διαφορά ηλεκτροαρνητικότητας | Κοινή χρήση ηλεκτρονίων |
| --- | --- | --- |
| Ιωνικός | Μεγάλο (τυπικά> 1,7) | Πλήρης μεταφορά |
| Πολικό ομοιοπολικό | Μέτρια (0,4 - 1,7) | Ανωτάτο κοινή χρήση |
| Μη πολική ομοιοπολική | Μικρό (λιγότερο από 0,4) Σχεδόν ίση κοινή χρήση |
Σημαντική σημείωση: Οι ίδιες οι τιμές ηλεκτροαρνητικότητας δεν είναι ο μόνος παράγοντας που πρέπει να ληφθεί υπόψη. Παράγοντες όπως το μέγεθος των ατόμων και η συγκεκριμένη διάταξη των ατόμων σε ένα μόριο παίζουν επίσης ρόλο στον προσδιορισμό του τύπου δεσμού.