Χρωματικά κωδικοποιημένος περιοδικός πίνακας
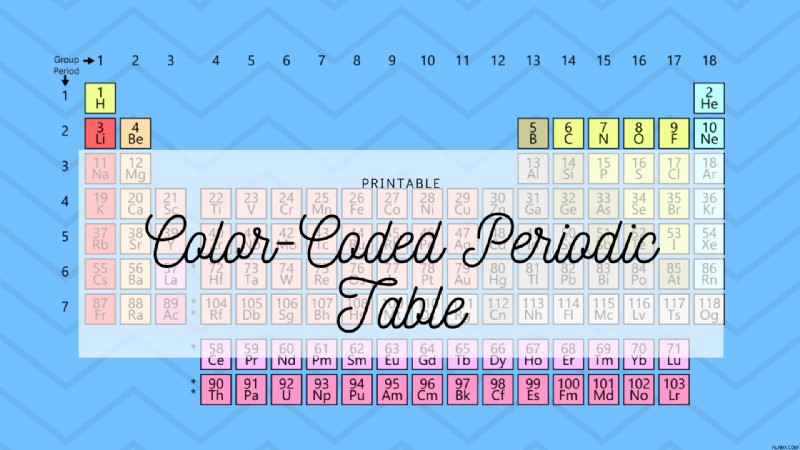
Ο χρωματικά κωδικοποιημένος περιοδικός πίνακας είναι μια πίνακας αναπαράστασης των διαφορετικών χημικών στοιχείων. Τα στοιχεία στον περιοδικό πίνακα μπορούν να κωδικοποιηθούν μαζί με χρώμα σύμφωνα με τον ατομικό αριθμό, τη διαμόρφωση ηλεκτρονίων και τις επαναλαμβανόμενες χημικές ιδιότητες. Επειδή υπάρχουν διάφοροι τρόποι ταξινόμησης των στοιχείων, υπάρχει ένας αριθμός σχημάτων κωδικοποίησης χρωμάτων που θα μπορούσαμε να χρησιμοποιήσουμε για να επισημάνουμε συγκεκριμένες ιδιότητες που μοιράζονται κοινές ομάδες στοιχείων.
Ένας από τους πιο συνηθισμένους τρόπους ομαδοποίησης στοιχείων στον περιοδικό πίνακα είναι οι ομαδοποιήσεις που βασίζονται σε γενικό τύπο στοιχείων, όπως ανά κατηγορίες, μέταλλο, μη μέταλλο και μεταλλοειδές.
Τι είναι ο περιοδικός πίνακας;
Πρώτα μερικά γενικά στοιχεία για τον περιοδικό πίνακα. Κάθε κύτταρο στον περιοδικό πίνακα έχει ένα σύμβολο για το στοιχείο, τον ατομικό αριθμό του στοιχείου που αντιστοιχεί στον αριθμό των πρωτονίων σε ένα άτομο αυτού του στοιχείου και το μέσο ατομικό βάρος αυτού του στοιχείου. Ο περιοδικός πίνακας είναι οργανωμένος σε έναν πίνακα οριζόντιων σειρών και κάθετων στηλών που ονομάζονται περιόδους και ομάδες , αντίστοιχα. Τα στοιχεία που είναι διατεταγμένα σε μια περίοδο παρουσιάζουν επαναλαμβανόμενες χημικές ιδιότητες καθώς πηγαίνετε από αριστερά προς τα δεξιά. Για παράδειγμα, τα στοιχεία στο αριστερό μέρος των σειρών έχουν λίγα εξωτερικά ηλεκτρόνια στο εξωτερικό τους περίβλημα και ο αριθμός αυξάνεται καθώς πηγαίνετε από αριστερά προς τα δεξιά.
Αυτές οι περιοδικές αλλαγές αντιστοιχούν σε περιοδικές αλλαγές στη χημική συμπεριφορά των στοιχείων καθώς προχωράτε κατά μήκος της σειράς. Το αποτέλεσμα είναι τα στοιχεία που είναι διατεταγμένα στις ίδιες ομάδες να έχουν παρόμοιες χημικές ιδιότητες. Για παράδειγμα, ο άνθρακας ανήκει στην ίδια ομάδα με το πυρίτιο καθώς και τα δύο παρουσιάζουν παρόμοιες χημικές ιδιότητες. Τόσο ο άνθρακας όσο και το πυρίτιο έχουν 4 ηλεκτρόνια ανοιχτού σθένους, γεγονός που εξηγεί γιατί παρουσιάζουν παρόμοιες χημικές ιδιότητες. Ομοίως, τόσο το φθόριο όσο και το χλώριο είναι αλογόνα και χαρακτηρίζονται από την τάση τους να σχηματίζουν αυθόρμητα ισχυρούς ιοντικούς δεσμούς με ηλεκτραρνητικά ασθενή στοιχεία.
Τώρα που έχουμε μερικά βασικά στοιχεία του περιοδικού πίνακα κάτω από τη ζώνη μας, ας προχωρήσουμε σε συγκεκριμένους τρόπους οργάνωσης των χημικών στοιχείων.
Χρωματικά κωδικοποιημένος περιοδικός πίνακας κατά τύπο στοιχείου
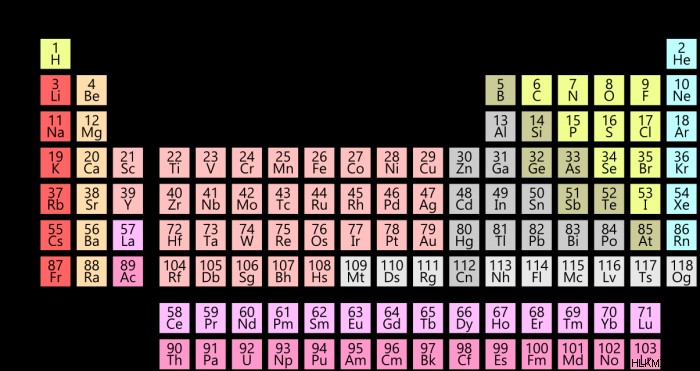
Στην παραπάνω φωτογραφία, τα στοιχεία είναι χρωματικά κωδικοποιημένα ανάλογα με τον γενικό τύπο ουσίας στον οποίο εμπίπτει το στοιχείο. Γενικά, οι χημικοί χωρίζουν τα στοιχεία σε τρεις κύριους τύπους:μέταλλα (μωβ) αμέταλλα (μπλε) και μεταλλοειδή (πράσινο). Αν και αυτές οι κατηγορίες χρησιμοποιούνται συνήθως, οι ταξινομήσεις στην άκρη έχουν κάπως ασαφή όρια. Για παράδειγμα, σε ορισμένες περιπτώσεις, το αρσενικό θα ταξινομηθεί ως μέταλλο λόγω των ισχυρών αγώγιμων ιδιοτήτων του. Σε άλλες περιπτώσεις, το αρσενικό ταξινομείται ως μεταλλοειδές καθώς είναι εύθραυστο σε θερμοκρασία δωματίου και διαλύεται εύκολα στο νερό. Αυτά τα ασαφή όρια αντικατοπτρίζουν απλώς το γεγονός ότι δεν υπάρχει καθολική συμφωνία σχετικά με το ποια στοιχεία εμπίπτουν σε αυτές τις κατηγορίες, αλλά γενικά, οι επιστήμονες εργάζονται με αυτή τη γενική κατανόηση της διαίρεσης των τύπων στοιχείων.
Μέταλλα
Τα στοιχεία που ταξινομούνται ως μέταλλα ενοποιούνται από την τάση τους να σχηματίζουν κατιόντα, να συνάπτουν μεταλλικούς χημικούς δεσμούς με άλλα μέταλλα, είναι επιρρεπή σε οξείδωση και είναι γενικά καλοί αγωγοί της θερμότητας και του ηλεκτρισμού. Τα μέταλλα αντιπροσωπεύουν τη μεγαλύτερη ταξινόμηση τύπου στοιχείου, καθώς περίπου 95 από τα 118 στοιχεία που ανακαλύφθηκαν είναι μέταλλα.
Όταν τα μεταλλικά στοιχεία σχηματίζουν ενώσεις, οι δεσμοί τους χαρακτηρίζονται από την μετεγκατάσταση ζευγών ηλεκτρονίων. Με άλλα λόγια, μια μεταλλική ένωση μπορεί να θεωρηθεί ως ένα θετικά φορτισμένο πλέγμα κατιόντων που μοιράζεται ελεύθερα ηλεκτρόνια σε όλη τη δομή του. Η χημική φύση των μεταλλικών δεσμών εξηγεί πολλές από τις μοναδικές ιδιότητες των μετάλλων, όπως η αντοχή, η ανθεκτικότητα, η στιλπνότητα και οι αγώγιμες ιδιότητες τους. Η κατηγορία των μετάλλων μπορεί περαιτέρω να χωριστεί σε σιδηρούχα (μαγνητικά) και μη σιδηρούχα μέταλλα, αλκάλια, μέταλλα μεταπτώσεως και βασικά μέταλλα κ.λπ. Ανάλογα με τις συγκεκριμένες ιδιότητες των μετάλλων που ενδιαφέρουν τον ερευνητή, θα τα ταξινομήσει σε διαφορετικές υποομάδες.
Μη μέταλλα
Με απλούστερους όρους, ένα αμέταλλο στον περιοδικό πίνακα είναι ένα στοιχείο που στερείται κυρίως μεταλλικών ιδιοτήτων. Τα μη μέταλλα έχουν γενικά χαμηλά σημεία τήξης και βρασμού, είναι συνήθως εύθραυστα σε θερμοκρασίες δωματίου, είναι κακοί αγωγοί της θερμότητας και του ηλεκτρισμού και συνήθως συνάπτουν ομοιοπολικούς ή ιοντικούς δεσμούς με άλλα στοιχεία.
Τα αμέταλλα μπορούν περαιτέρω να χωριστούν σε δύο κατηγορίες: ευγενή αέρια και αντιδραστικά αμέταλλα . Τα ευγενή αέρια, που αποτελούν την πιο αριστερή ομάδα του περιοδικού πίνακα και περιλαμβάνουν στοιχεία όπως το νέο ή το αργό, χαρακτηρίζονται από τη χημική τους αδράνεια. Τα ευγενή αέρια είναι χημικά αδρανή επειδή έχουν ένα πλήρες κέλυφος σθένους ηλεκτρονίων και έτσι έχουν μια πολύ σταθερή διαμόρφωση ηλεκτρονίων. Τα αντιδραστικά αμέταλλα, όπως θα υπονοούσε το όνομα, αναφέρονται σε οποιαδήποτε αμέταλλα που αντιδρούν εύκολα με άλλα στοιχεία. Λιγότερα ηλεκτραρνητικά αμέταλλα, όπως ο άνθρακας ή το θείο, διατίθενται για να σχηματίσουν ομοιοπολικούς δεσμούς με την κοινή χρήση ηλεκτρονίων. Τα περισσότερα ηλεκτραρνητικά αμέταλλα, όπως το οξυγόνο ή τα αλογόνα (ομάδα 7) είναι πολύ πιο αντιδραστικά και σχηματίζουν εύκολα ισχυρούς ιοντικούς δεσμούς με μέταλλα.
Μεταλλοειδή
Τα μεσαία τμήματα του περιοδικού πίνακα καταλαμβάνουν τα αραιοκατοικημένα μεταλλοειδή (ημιμέταλλα). Όπως θα υπονοούσε το όνομα, τα μεταλλοειδή παρουσιάζουν ένα μοναδικό μείγμα μεταλλικών και μη μεταλλικών ιδιοτήτων, έτσι ώστε τα μεταλλοειδή να μην εμπίπτουν σαφώς σε μεταλλικές ή μη μεταλλικές κατηγορίες. Τα έξι πιο κοινά αναγνωρισμένα μεταλλοειδή είναι το βόριο, το πυρίτιο, το αρσενικό γερμάνιο, το αντιμόνιο και το τελλούριο. Όπως τα μέταλλα, έτσι και τα μεταλλοειδή παρουσιάζουν μια χαρακτηριστική λάμψη και είναι γενικά δίκαιοι αγωγοί της θερμότητας και του ηλεκτρισμού. Όπως τα μη μέταλλα, τα μεταλλοειδή είναι συνήθως εύθραυστα σε θερμοκρασίες δωματίου και γενικά σχηματίζουν ομοιοπολικούς δεσμούς με άλλα στοιχεία.
Ένα από τα πιο σημαντικά είδη μεταλλοειδών είναι το πυρίτιο, ένας ημιαγωγός που έχει αποτελέσει τη ραχοκοκαλιά της σύγχρονης βιομηχανίας ηλεκτρονικών. Το πυρίτιο είναι ένα σχετικά φθηνό και άφθονο φυσικό υλικό που παρουσιάζει ισχυρές αγώγιμες ιδιότητες σε θερμοκρασία δωματίου και αποτελεί έναν ιδανικό αγωγό για χρήση στα σύγχρονα ηλεκτρονικά.
Υπάρχουν διάφοροι άλλοι τρόποι οργάνωσης στοιχείων στον περιοδικό πίνακα. Μπορείτε να οργανώσετε στοιχεία με βάση τις ηλεκτραρνητικότητες τους, τις δεσμευτικές τους ιδιότητες, την ικανότητά τους να διαλύονται σε διαλύτες, την ενέργεια ιονισμού ή την τροχιακή τους διάταξη ηλεκτρονίων. Η οργάνωση κατά γενικό τύπο στοιχείου αντιπροσωπεύει απλώς έναν τρόπο με τον οποίο οι χημικοί προσπάθησαν να καταλογίσουν το ευρύ φάσμα των χημικών στοιχείων της φύσης.