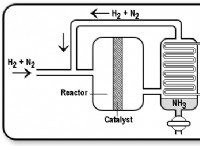
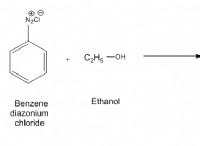
Τι εξηγούν τα ισοηλεκτρονικά ιόντα με παράδειγμα;
Ισοηλεκτρονικά ιόντα:Κοινή χρήση του ίδιου αριθμού ηλεκτρονίων
Ισοηλεκτρονικά ιόντα είναι ιόντα που έχουν τον ίδιο αριθμό ηλεκτρονίων. Αυτό σημαίνει ότι έχουν την ίδια ηλεκτρονική διαμόρφωση, παρόλο που μπορεί να έχουν διαφορετικό αριθμό πρωτονίων και νετρονίων.
Εδώ λειτουργεί:
1. ιόντα: Τα άτομα μπορούν να κερδίσουν ή να χάσουν ηλεκτρόνια για να γίνουν ιόντα. Τα κατιόντα είναι θετικά φορτισμένα ιόντα (χαμένα ηλεκτρόνια) και τα ανιόντα είναι αρνητικά φορτισμένα ιόντα (αποκτηθέντα ηλεκτρόνια).
2. Isoelectronic: Εάν δύο ιόντα έχουν τον ίδιο αριθμό ηλεκτρονίων, θεωρούνται ισοηλεκτρονικά.
3. Ηλεκτρονική διαμόρφωση: Η διάταξη των ηλεκτρονίων σε τα επίπεδα ενέργειας ενός ατόμου είναι η ηλεκτρονική διαμόρφωση του. Τα ισοηλεκτρονικά ιόντα μοιράζονται την ίδια ηλεκτρονική διαμόρφωση.
Παράδειγμα:
* n³⁻ (ιόν νιτρίδιο): Το άζωτο έχει 7 ηλεκτρόνια. Όταν κερδίζει 3 ηλεκτρόνια, γίνεται n³⁻ με 10 ηλεκτρόνια.
* o²⁻ (ιόν οξειδίου): Το οξυγόνο έχει 8 ηλεκτρόνια. Όταν κερδίζει 2 ηλεκτρόνια, γίνεται o²⁻ με 10 ηλεκτρόνια.
* f⁻ (ιόν φθοριούχου): Το φθόριο έχει 9 ηλεκτρόνια. Όταν κερδίζει 1 ηλεκτρόνιο, γίνεται F⁻ με 10 ηλεκτρόνια.
* ne (neon): Το νέον είναι ένα ευγενές αέριο με 10 ηλεκτρόνια.
Και τα τέσσερα είδη (n³⁻, o²⁻, f⁻ και ne) έχουν 10 ηλεκτρόνια το καθένα, καθιστώντας τα ισοηλεκτρονικά.
Σημαντικά σημεία:
* Μέγεθος: Τα ισοηλεκτρονικά ιόντα με τον ίδιο αριθμό ηλεκτρονίων θα έχουν διαφορετικές ιοντικές ακτίνες λόγω των διαφορετικών πυρηνικών φορτίων. Όσο υψηλότερο είναι το πυρηνικό φορτίο, τόσο ισχυρότερη είναι η έλξη των ηλεκτρονίων, με αποτέλεσμα μια μικρότερη ιοντική ακτίνα.
* Χημικές ιδιότητες: Ενώ τα ισοηλεκτρονικά ιόντα έχουν τον ίδιο αριθμό ηλεκτρονίων και παρόμοιες ηλεκτρονικές διαμορφώσεις, οι χημικές τους ιδιότητες μπορεί να διαφέρουν σημαντικά λόγω των ποικίλων πυρηνικών φορτίων.
Περισσότερα παραδείγματα:
* na⁺ (ιόν νατρίου) και ne (neon) είναι ισοηλεκτρονικά.
* mg2⁺ (ιόν μαγνησίου) και na⁺ (ιόν νατρίου) είναι ισοηλεκτρονικά.
* cl⁻ (χλωριούχο ιόν) και ar (αργόν) είναι ισοηλεκτρονικά.
Η κατανόηση των ισοηλεκτρονικών ιόντων μας βοηθά να προβλέψουμε το φορτίο των ιόντων, να συγκρίνουμε τα μεγέθη τους και να κατανοήσουμε τη χημική τους συμπεριφορά.