Υδρόλυση Αλατιού
Τα άλατα είναι ενώσεις που σχηματίζονται από την αντίδραση εξουδετέρωσης μεταξύ οξέων και βάσεων. Γενικά ιονίζονται στο νερό, παράγοντας κατιόντα και ανιόντα. Κατιόντα ή ανιόντα που σχηματίζονται κατά τον ιονισμό του άλατος είτε υπάρχουν ως ενυδατωμένα ιόντα σε υδατικό διάλυμα είτε αλληλεπιδρούν με το νερό για την αναγέννηση οξέων και βάσεων. Η διαδικασία της αλληλεπίδρασης αλάτων μεταξύ κατιόντων ή ανιόντων και νερού είναι γνωστή ως υδρόλυση άλατος. Με βάση την υδρόλυση, τα άλατα χωρίζονται σε τρεις κατηγορίες.
Όξινα άλατα
Βασικά άλατα
Ουδέτερα άλατα
Τύποι αλατιού με βάση την υδρόλυση τους
Άλατα ισχυρού οξέος και ισχυρής βάσης:Το άλας που σχηματίζεται από την εξουδετέρωση ισχυρών οξέων και ισχυρών βάσεων είναι ουσιαστικά ουδέτερο επειδή οι δεσμοί δεν διασπώνται στο διάλυμα αλατιού. Γενικά είναι ενυδατωμένα αλλά δεν υδρολύονται. Επομένως, τέτοια άλατα είναι κοινώς γνωστά ως ουδέτερα άλατα. Για παράδειγμα:NaCl
Το NaCl διασπάται στο νερό για να σχηματίσει ιόντα Na + και Cl–.
Όταν αυτά τα ιόντα αντιδρούν με το νερό, το προϊόν γίνεται NaOH και HCl. Αυτοί είναι ισχυροί ηλεκτρολύτες και είναι πλήρως ιονισμένοι. Τα H + και
ΟΗ-ιόντα στη συνέχεια ανασυνδυάζονται για να σχηματίσουν αδιάσπαστα μόρια νερού. Είναι ουδέτερο.
Άλατα ασθενούς οξέος και ισχυρής βάσης:Τα άλατα που σχηματίζονται από την εξουδετέρωση ασθενών οξέων και ισχυρών βάσεων είναι βασικά βασικά. Για παράδειγμα, CH3COONa
CH3COONa → CH3COO– + Na+
CH3COO– + H2O ↔ CH3COOH + OH –
∴ [OH–]> [H+ ] επομένως η λύση είναι βασικής φύσης
Το οξικό οξύ είναι ασθενές οξύ και δεν παραμένει δεσμευμένο στο διάλυμα. Αυτό αυξάνει τη συγκέντρωση των ιόντων ΟΗ- και καθιστά το διάλυμα αλκαλικό. Το pH του διαλύματος είναι μεγαλύτερο από 7.
Άλατα ισχυρού οξέος και ασθενούς βάσης:Τα άλατα που σχηματίζονται από την εξουδετέρωση ισχυρών οξέων και οι ασθενείς βάσεις είναι εγγενώς όξινα. Για παράδειγμα:NH4Cl
Η υδρόλυση του NH4Cl μπορεί να αναπαρασταθεί ως εξής:
NH4Cl + H2O ↔ NH4OH + HCl
Ή NH4+ + Cl– + H2O ↔ NH4OH + H+ + Cl–
Καθώς παράγει ιόντα H+, έτσι και το διάλυμα ενός τέτοιου άλατος έχει όξινο χαρακτήρα.
Το υδροξείδιο της αμμωνίας είναι αδύναμη βάση και παραμένει ομοιόμορφα στο διάλυμα. Αυτό αυξάνει τη συγκέντρωση των ιόντων Η+ και καθιστά το διάλυμα όξινο. Το pH ενός τέτοιου διαλύματος είναι μικρότερο από 7.
Άλατα ασθενούς οξέος και ασθενούς βάσης:Τα άλατα που σχηματίζονται από την εξουδετέρωση ασθενών οξέων και βάσεων είναι όξινα, βασικά ή ουδέτερα, ανάλογα με τη φύση των οξέων και εμπλεκόμενες βάσεις. Για παράδειγμα:CH3COONH4
Είναι ουδέτερο γιατί
CH3COONH4 → CH3COO– + NH4+
CH3COO– + H2O ↔ CH3COOH + OH –
NH4+ + H2O ↔ NH4OH + H+
Και οι δύο αντιδράσεις λαμβάνουν χώρα με την ίδια ταχύτητα, επομένως, το διάλυμα είναι ουδέτερο στη φύση.
Εξίσωση υδρόλυσης άλατος
Τα άλατα είναι ιοντικές ενώσεις που σχηματίζονται όταν τα οξέα και οι βάσεις εξουδετερώνουν το ένα το άλλο. Το αλατούχο διάλυμα φαίνεται πάντα ουδέτερο, αλλά συχνά είναι είτε όξινο είτε βασικό.
Σκεφτείτε το άλας που σχηματίζεται όταν το ασθενώς όξινο υδροφθορικό οξύ εξουδετερώνεται από την ισχυρή βάση υδροξείδιο του νατρίου. Ο μοριακός τύπος και ο καθαρός ιοντικός τύπος φαίνονται παρακάτω.
HF (aq) + NaOH(aq) → NaF(aq) +H2O(l)
HF (aq) + OH–(aq) → F–(aq) +H2O(l)
Το φθοριούχο νάτριο είναι ένα ιόν θεατή για την αντίδραση εξουδετέρωσης επειδή είναι διαλυτό. Τα ιόντα φθορίου μπορούν να αντιδράσουν ελαφρώς με το νερό δεχόμενοι πρωτόνια.
F–(aq) + H2O(l) ↔ HF (aq) + OH–(aq)
Τα ιόντα φθορίου δρουν ως ασθενείς βάσεις Bronsted-Lowry. Τα ιόντα υδροξειδίου που παράγονται ως αποτέλεσμα της παραπάνω αντίδρασης καθιστούν το διάλυμα ελαφρώς βασικό. Η υδρόλυση άλατος είναι μια αντίδραση κατά την οποία ένα από τα ιόντα του άλατος αντιδρά με το νερό για να σχηματίσει ένα όξινο ή βασικό διάλυμα.
Αλάτι που σχηματίζει Βασικό Διάλυμα
Όταν το στερεό φθοριούχο νάτριο διαλύεται στο νερό, διασπάται πλήρως σε ιόντα νατρίου και φθορίου. Τα ιόντα νατρίου δεν μπορούν να υδρολυθούν, αλλά τα ιόντα φθορίου υδρολύονται για να παράγουν μικρές ποσότητες υδροφθορικού οξέος και ιόντων υδροξειδίου.
F–(aq) + H2O(l) ↔ HF (aq) + OH–(aq)
Το άλας που προκύπτει από την εξουδετέρωση του ασθενούς οξέος (HF) με την ισχυρή βάση (NaOH) παράγει πάντα ένα βασικό διάλυμα άλατος.
Αλάτι που σχηματίζει όξινο διάλυμα
Το χλωριούχο αμμώνιο (NH4Cl) είναι ένα άλας που σχηματίζεται όταν το ισχυρό οξύ HCl εξουδετερώνεται από την ασθενή βάση NH3. Το χλωριούχο αμμώνιο είναι υδατοδιαλυτό. Το ιόν χλωρίου που παράγεται είναι μια συζευγμένη βάση του ισχυρού οξέος HCl και δεν μπορεί να υδρολυθεί. Με άλλα λόγια, το ιόν Cl- δεν μπορεί να λάβει πρωτόνια από το νερό για να σχηματίσει HCl και OH-, όπως έκανε το ιόν φθορίου στην προηγούμενη ενότητα. Ωστόσο, τα ιόντα αμμωνίου δρουν ως οξέα επειδή μπορούν εύκολα να αντιδράσουν με το νερό για να δώσουν πρωτόνια.
NH4+(aq) + H2O(l) ↔ H3O+ + NH3(aq)
Αλάτι που σχηματίζει φυσικό διάλυμα
Τα άλατα που προκύπτουν από την αντίδραση ισχυρών οξέων με ισχυρές βάσεις σχηματίζουν διάλυμα σε pH 7. Ένα παράδειγμα είναι το χλωριούχο νάτριο που προκύπτει από την εξουδετέρωση του HCl με NaOH. NaCl Ένα υδατικό διάλυμα δεν είναι ούτε όξινο ούτε βασικό γιατί και τα δύο ιόντα δεν μπορούν να υδρολυθούν. Άλλα άλατα που σχηματίζουν ένα ουδέτερο διάλυμα περιλαμβάνουν το νιτρικό κάλιο (KNO3) και το βρωμιούχο λίθιο (LiBr).
Τα άλατα που σχηματίζονται από την αντίδραση ασθενών οξέων και αδύναμων βάσεων είναι πιο δύσκολο να αναλυθούν επειδή η αντίδραση υδρόλυσης ανταγωνίζεται κατιόντα και ανιόντα.
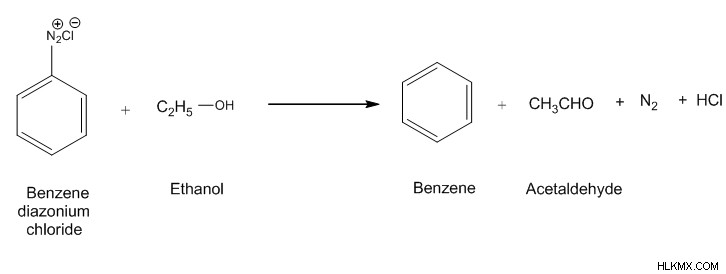
Υδρόλυση χλωριούχου βενζολίου διαζωνίου
Όταν το χλωριούχο βενζολοδιαζώνιο υδρολύεται, τα μόρια του αζώτου διαφεύγουν ως αέριο άζωτο. Οι ομάδες ΟΗ στο νερό επιτίθενται στις κενές θέσεις που παραμένουν μετά την απομάκρυνση του αερίου αζώτου. Αυτό οδηγεί στο σχηματισμό φαινόλης.
Συμπέρασμα
Τα άλατα είναι ιοντικές ενώσεις που αποτελούνται από κατιόντα και ανιόντα, καθένα από τα οποία μπορεί να προκαλέσει μια αντίδραση ιονισμού οξέος ή βάσης με το νερό. Έτσι, το υδατικό διάλυμα άλατος μπορεί να είναι όξινο, βασικό ή ουδέτερο, ανάλογα με τη σχετική ισχύ οξέος-βάσης των συστατικών ιόντων του άλατος. Το καθαρό νερό είναι ένας αδύναμος ηλεκτρολύτης. δεν διασπάται πλήρως σε υδρογόνο και υδροξείδιο, αλλά είναι αδύναμο επειδή υπάρχει σε ισορροπία με αυτά τα δύο ιόντα. Είναι ουσιαστικά ουδέτερο. Η συγκέντρωση ιόντων H+ είναι ακριβώς ίση με τη συγκέντρωση ιόντων ΟΗ. Όταν αυτή η κατάσταση διαταράσσεται με τη μείωση της συγκέντρωσης οποιουδήποτε ιόντος, η ουδέτερη φύση μεταβάλλεται σε όξινη ή βασική. Εάν [H+]> [OH], το νερό θα είναι όξινο, εάν [H+] < [OH], το νερό θα είναι βασικό. Αυτή είναι ακριβώς η αλλαγή που συμβαίνει κατά τη διάρκεια ενός φαινομένου που είναι γνωστό ως υδρόλυση άλατος. Ορίζεται ως μια αντίδραση κατά την οποία τα κατιόντα και/ή τα ανιόντα ενός άλατος αντιδρούν με το νερό για να παράγουν οξύ ή αλκαλικότητα.




