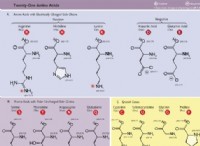
Πώς ενώνουν τα άτομα μαζί για να κάνουν μια ένωση;
Δείτε πώς λειτουργεί:
1. Τα άτομα έχουν διαφορετικές ικανότητες για να προσελκύσουν ηλεκτρόνια. Αυτή η ιδιότητα ονομάζεται ηλεκτροαρνητικότητα. Όσο υψηλότερη είναι η ηλεκτροαρνητικότητα, τόσο περισσότερο ένα άτομο θέλει να κερδίσει ηλεκτρόνια.
2. Τύποι σύνδεσης: Υπάρχουν δύο κύριοι τύποι χημικής σύνδεσης:
* Ιονική σύνδεση: Αυτό συνεπάγεται τη μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο. Το άτομο που χάνει ένα ηλεκτρόνιο γίνεται θετικά φορτισμένο (κατιόν) και το άτομο που κερδίζει ένα ηλεκτρόνιο γίνεται αρνητικά φορτισμένο (ανιόν). Οι αντίθετες χρεώσεις προσελκύουν ο ένας τον άλλον, σχηματίζοντας ένα ιοντικό δεσμό. Για παράδειγμα, το νάτριο (Na) χάνει ένα ηλεκτρόνιο για να γίνει Na+, ενώ το χλώριο (CL) κερδίζει ένα ηλεκτρόνιο για να γίνει cl-. Αυτά τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον για να σχηματίσουν χλωριούχο νάτριο (NaCl) ή επιτραπέζιο αλάτι.
* ομοιοπολική σύνδεση: Αυτό συνεπάγεται την κατανομή των ηλεκτρονίων μεταξύ των ατόμων. Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν ένα σταθερό εξωτερικό κέλυφος, με αποτέλεσμα έναν ομοιοπολικό δεσμό. Αυτό είναι κοινό μεταξύ των μη μεταλλικών. Για παράδειγμα, δύο άτομα υδρογόνου μοιράζονται τα ηλεκτρόνια τους για να σχηματίσουν έναν ομοιοπολικό δεσμό στο μόριο Η2.
3. Κοινή χρήση εναντίον μεταφοράς:
* Σε ιονική σύνδεση , τα ηλεκτρόνια μεταφέρονται πλήρως από το ένα άτομο στο άλλο.
* Σε ομοιοπολική σύνδεση , τα ηλεκτρόνια μοιράζονται μεταξύ των ατόμων.
4. Αντοχή των δεσμών:
* Ιονικά ομόλογα είναι γενικά ισχυρότεροι από ομοιοπολικοί δεσμοί .
* ομοιοπολικά ομόλογα μπορεί να κατηγοριοποιηθεί περαιτέρω σε single , διπλό , ή τριπλά ομόλογα με βάση τον αριθμό των κοινών ζευγών ηλεκτρονίων.
Παραδείγματα:
* νερό (H2O): Δύο άτομα υδρογόνου μοιράζονται ηλεκτρόνια με άτομο οξυγόνου μέσω ομοιοπολικής σύνδεσης.
* διοξείδιο του άνθρακα (CO2): Το Carbon μοιράζεται ηλεκτρόνια με δύο άτομα οξυγόνου μέσω διπλών ομοιοπολικών δεσμών.
* Χλωριούχο νάτριο (NaCl): Το νάτριο χάνει ένα ηλεκτρόνιο για να γίνει κατιόν (Na+), και το χλώριο κερδίζει ένα ηλεκτρόνιο για να γίνει ένα ανιόν (Cl-), σχηματίζοντας έναν ιοντικό δεσμό.
Συνοπτικά: Τα άτομα σχηματίζουν ενώσεις για να επιτευχθούν σταθερή διαμόρφωση ηλεκτρονίων. Μπορούν να το κάνουν αυτό είτε μεταφέροντας ηλεκτρόνια (ιοντική σύνδεση) είτε με κοινή χρήση ηλεκτρονίων (ομοιοπολική σύνδεση).