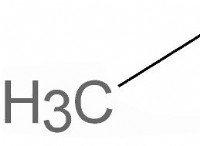
Καθαρή ιοντική εξίσωση για NAH2PO4 και HCl;
1. Γράψτε την πλήρη ιοντική εξίσωση:
* nah₂po₄ (aq) → na⁺ (aq) + h₂po₄⁻ (aq) (Φωσφορικό διυδρογόνο νάτριο διαχωρίζεται πλήρως σε διάλυμα)
* hcl (aq) → h⁺ (aq) + cl⁻ (aq) (Το υδροχλωρικό οξύ διαχωρίζεται εντελώς σε διάλυμα)
Η πλήρης ιοντική εξίσωση είναι:
na⁺ (aq) + h₂po₄⁻ (aq) + h⁺ (aq) + cl⁻ (aq) → na⁺ (aq) + cl⁻ (aq) + h₃po₄ (aq)
2. Προσδιορίστε ιόντα θεατών:
* na⁺ (aq) και cl⁻ (aq) εμφανίζονται και στις δύο πλευρές της εξίσωσης. Αυτά είναι ιόντα θεατών, που σημαίνει ότι δεν συμμετέχουν στην πραγματική αντίδραση.
3. Γράψτε την καθαρή ιοντική εξίσωση:
Αφαιρέστε τα ιόντα θεατών από την πλήρη ιοντική εξίσωση:
h₂po₄⁻ (aq) + h⁺ (aq) → h₃po₄ (aq)
καθαρή ιοντική εξίσωση:h₂po₄⁻ (aq) + h⁺ (aq) → h₃po₄ (aq)
Επεξήγηση:
Η αντίδραση περιλαμβάνει τη μεταφορά ενός πρωτονίου (H⁺) από το ισχυρό οξύ (HCl) στο ιόν φωσφορικού διυδρογόνου (H₂po₄⁻), σχηματίζοντας φωσφορικό οξύ (H₃po₄).