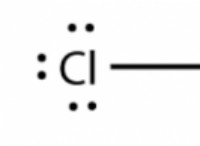Τι είναι η Βάση στη Χημεία; Ορισμός και Παραδείγματα
Στη χημεία, μια βάση είναι μια ουσία που αντιδρά με οξέα για να σχηματίσει ένα άλας και η οποία απελευθερώνει ιόντα υδροξειδίου, δέχεται πρωτόνια ή δίνει ηλεκτρόνια σε υδατικό διάλυμα. Μάθετε για τις ιδιότητες των βάσεων και δείτε παραδείγματα βάσεων και τις χρήσεις τους.
Βασικός ορισμός
Όλες οι βάσεις αντιδρούν με οξέα για να σχηματίσουν άλατα, αλλά υπάρχουν διαφορετικοί ορισμοί για το τι ακριβώς είναι μια βάση. Κάθε ορισμός βάσης έχει έναν αντίστοιχο ορισμό οξέος.
- Arrhenius :Μια βάση Arrhenius απελευθερώνει ιόντα υδροξειδίου (ΟΗ) σε υδατικό διάλυμα. Ένα οξύ Arrhenius απελευθερώνει ιόντα υδρογόνου (Η) σε υδατικό διάλυμα. Μια βάση δεν χρειάζεται να έχει υδροξείδιο (ΟΗ) στον τύπο της για να είναι βάση Arrhenius. Για παράδειγμα, αμμωνία (NH3 ) αντιδρά στο νερό σχηματίζοντας το ιόν αμμωνίου (NH4 ) και το ιόν υδροξειδίου (ΟΗ).
- Brønsted –Lowry :Μια βάση Brønsted-Lowry είναι ένας δέκτης πρωτονίων. Ένα οξύ Arrhenius είναι ένας δέκτης πρωτονίων.
- Λούις: Μια βάση Lewis είναι ένας δότης ζεύγους ηλεκτρονίων. Ένα οξύ Arrhenius είναι ένας δέκτης ζεύγους ηλεκτρονίων.
Τα οξέα και οι βάσεις μπορεί να φαίνονται σαν αντίθετα είδη στις χημικές αντιδράσεις, αλλά ορισμένες ουσίες μπορούν να λειτουργήσουν είτε ως οξύ είτε ως βάση. Ένα τέτοιο είδος λέγεται ότι είναι αμφοτερικό . Το νερό είναι ένα κλασικό παράδειγμα, καθώς μπορεί να λειτουργήσει ως ασθενές οξύ (δωρίζοντας ιόν υδρογόνου ή πρωτόνιο) ή ασθενές οξύ (δωρεά OH ή αποδοχή πρωτονίου για να σχηματίσει H3 O+ ).
Ισχυρές και αδύναμες βάσεις
Μια ισχυρή βάση είναι μια ένωση που διασπάται πλήρως στα ιόντα της σε υδατικό διάλυμα. Μια αδύναμη βάση διασπάται ατελώς στα ιόντα του, έτσι ώστε το υδατικό διάλυμα που προκύπτει να περιέχει ασθενή βάση, το συζυγές οξύ του και νερό.
Ισχυρή βάση:BOH + H2 O → B(aq) + OH(aq)
Αδύναμη βάση:BOH + H2 O ↔ B(aq) + OH(aq)
ή
Αδύναμη βάση:B + H2 O ↔ BH(aq) + OH(aq)
Οι ισχυρές βάσεις είναι κλασικές βάσεις Arrhenius κατασκευασμένες από μέταλλα αλκαλίων ή αλκαλικών γαιών και ιόντα υδροξειδίου.
| Κοινή ισχυρή βάση | Τύπος |
|---|---|
| υδροξείδιο του βαρίου | Ba(OH)2 |
| υδροξείδιο του ασβεστίου | Ca(OH)2 |
| υδροξείδιο του καισίου | CsOH |
| υδροξείδιο του λιθίου | LiOH |
| υδροξείδιο του καλίου | KOH |
| υδροξείδιο του ρουβιδίου | RbOH |
| υδροξείδιο του νατρίου | NaOH |
| υδροξείδιο του στροντίου | Sr(OH)2 |
Το υδροξείδιο του ασβεστίου, το υδροξείδιο του στροντίου και το υδροξείδιο του βαρίου διασπώνται πλήρως μόνο σε διαλύματα με τιμές συγκέντρωσης 0,01 M ή χαμηλότερες.
Οι αδύναμες βάσεις περιλαμβάνουν τις συζευγμένες βάσεις οξέων και πολλές άλλες ενώσεις, που συχνά περιέχουν υδρογόνο ή άζωτο.
| Κοινή αδύναμη βάση | Τύπος |
|---|---|
| αμμωνία | NH3 |
| τριμεθυλαμμωνία | N(CH3 )3 |
| πυριδίνη | C5 H5 N |
| υδροξείδιο του αμμωνίου | NH4 OH |
| νερό | H2 O |
| μεθυλαμίνη | CH3 NH2 |
| όξινο ανθρακικό νάτριο | NaHCO3 |
Άλλοι τύποι βάσεων
Άλλοι τύποι βάσεων περιλαμβάνουν υπερβάσεις, ουδέτερες βάσεις και συμπαγείς βάσεις.
- Superbase :Μια υπερβάση είναι μια βάση Lewis που αποπρωτονιώνεται ακόμα καλύτερα από μια ισχυρή βάση. Οι υπερβάσεις έχουν πολύ αδύναμα συζευγμένα οξέα. Σχηματίζονται με την ανάμειξη ενός αλκαλιμετάλλου (π.χ. λιθίου, νατρίου) με το συζυγές οξύ του. Οι υπερβάσεις δεν παραμένουν σε υδατικό διάλυμα επειδή είναι ισχυρότερες βάσεις από το ιόν υδροξειδίου. Ένα απλό παράδειγμα υπερβάσης είναι το υδρίδιο του νατρίου (NaH). Η ισχυρότερη υπερβάση είναι το διαιόν ορθο-διαιθυνυλοβενζολίου (C6 H4 (Γ2 )2 ).
- Ουδέτερη βάση :Μια ουδέτερη βάση σχηματίζει δεσμό με ένα ουδέτερο οξύ. Το οξύ και η βάση μοιράζονται ένα ζεύγος ηλεκτρονίων.
- Στερεά βάση :Μια συμπαγής βάση λειτουργεί ως βάση σε στερεή μορφή. Διοξείδιο του πυριτίου (SiO2 ) και το υδροξείδιο του νατρίου (NaOH) τοποθετημένο σε αλουμίνα είναι παραδείγματα στερεών βάσεων. Οι στερεές βάσεις χρησιμοποιούνται σε αντιδράσεις με αέρια οξέα και σε ρητίνες ανταλλαγής ανιόντων.
Ιδιότητες βάσεων
Οι βάσεις εμφανίζουν πολλές χαρακτηριστικές ιδιότητες:
- Οι βάσεις έχουν πικρή γεύση. (Μην το δοκιμάσετε.)
- Αισθάνονται ότι γλιστράει ή είναι σαπουνάδα. (Μην το δοκιμάσετε.)
- Τα βασικά διαλύματα έχουν τιμές pH μεγαλύτερες από 7.
- Μια βάση γίνεται μπλε χαρτί λακκούβας. Γίνεται κίτρινο μεθυλοπορτοκαλί και ροζ δείκτης φαινολοφθαλεΐνης. Το μπλε της βρωμοθυμόλης παραμένει μπλε παρουσία βάσης.
- Οι ισχυρές βάσεις και οι συγκεντρωμένες αδύναμες βάσεις είναι καυστικές. Αντιδρούν έντονα με οξέα και οργανική ύλη και μπορούν να προκαλέσουν χημικά εγκαύματα.
- Οι λιωμένες βάσεις και οι υδατικές βάσεις είναι ηλεκτρολύτες. Αγάγουν ηλεκτρισμό.
- Οι βάσεις αντιδρούν με οξέα για να σχηματίσουν αλάτι και νερό.
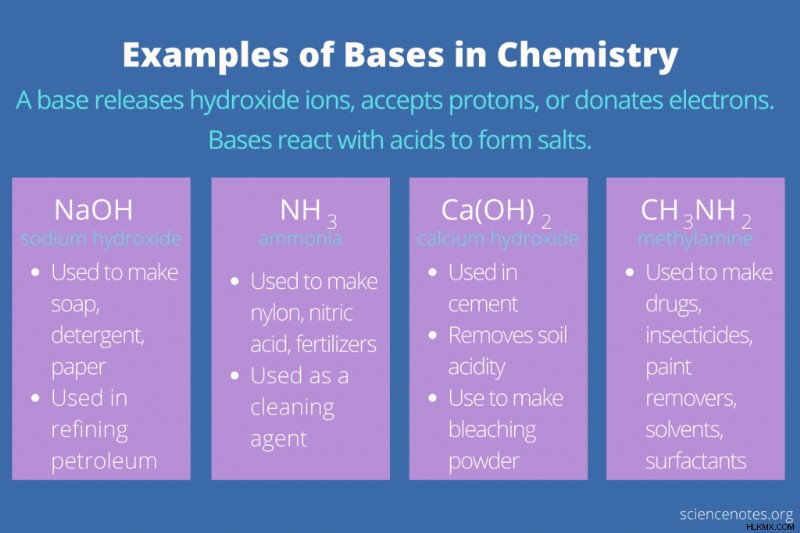
10 Παραδείγματα βάσεων και οι χρήσεις τους
Ακολουθούν 10 παραδείγματα βάσεων, οι τύποι τους και οι χρήσεις τους.
| Όνομα | Τύπος | Χρήσεις |
| υδροξείδιο του νατρίου | NaOH | Κατασκευή σαπουνιού, απορρυπαντικού, χαρτιού. καθαριστικό αποχέτευσης? διύλιση πετρελαίου |
| υδροξείδιο του καλίου | KOH | Παρασκευή σαπουνιού. ηλεκτρολύτης μπαταρίας |
| υδροξείδιο του ασβεστίου | Ca(OH)2 | Κατασκευή γύψου. παραγωγή δέρματος |
| υδροξείδιο του μαγνησίου | Mg(OH)2 | Καθαρτικό; αντιόξινα |
| αμμωνία | NH3 | Παραγωγή νάιλον, νιτρικού οξέος, λιπασμάτων. καθαριστικό |
| υδροξείδιο του αργιλίου | Al(OH)3 | Αντιόξινα; αποσμητικό |
| μεθυλαμίνη | CH3 NH2 | Παραγωγή φαρμάκων, εντομοκτόνων, αφαίρεσης χρωμάτων, επιφανειοδραστικών ουσιών |
| πυριδίνη | C5 H5 N | Μετουσιωτικό αλκοόλ; διαλυτικό μέσο; φτιάχνοντας βαφές, φάρμακα, προϊόντα από καουτσούκ, βιταμίνες |
| υδροξείδιο του ψευδαργύρου | Zn(OH)2 | Απορροφητικό σε χειρουργικούς επιδέσμους. παραγωγή φυτοφαρμάκων και χρωστικών ουσιών |
| υδροξείδιο του λιθίου | LiOH | Κατασκευή λιπαντικού γράσου και αναπνευστήρων |
Αντίδραση μεταξύ ενός οξέος και μιας βάσης
Ένα οξύ και μια βάση αντιδρούν σε μια αντίδραση εξουδετέρωσης που σχηματίζει άλας και νερό. Το άλας μπορεί να διασπαστεί στα ιόντα του ή, εάν είναι αδιάλυτο ή κορεσμένο, μπορεί να καταβυθιστεί εκτός διαλύματος ως στερεό.
Αναφορές
- Jensen, William B. (2006). «Η προέλευση του όρου «βάση». The Journal of Chemical Education . 83 (8):1130. doi:10.1021/ed083p1130
- Johll, Matthew E. (2009). Διερευνώντας τη Χημεία:Μια προοπτική της εγκληματολογικής επιστήμης (2η έκδ.). Νέα Υόρκη:W. H. Freeman and Co. ISBN 1429209895.
- Whitten, Kenneth W.; Peck, Larry; Davis, Raymond E.; Lockwood, Lisa; Stanley, George G. (2009). Χημεία (9η έκδ.). ISBN 0-495-39163-8.
- Zumdahl, Steven; DeCoste, Donald (2013). Χημικές Αρχές (7η έκδ.). Mary Finch.