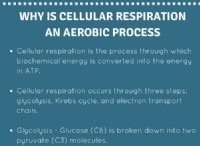
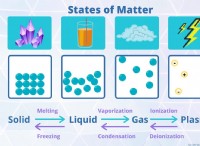
Γιατί το υδρογόνο έχει τον παραπάνω αριθμό οξείδωσης με άλλα μη μέταλλα;
* Το υδρογόνο είναι γενικά +1: Το υδρογόνο είναι περισσότερο ηλεκτροαρνητικό από τα περισσότερα μέταλλα, οπότε όταν συνδέεται με ένα μέταλλο, κερδίζει ένα ηλεκτρόνιο και παίρνει έναν αριθμό οξείδωσης -1. Για παράδειγμα, στο NAH (υδρίδιο νατρίου), το υδρογόνο έχει αριθμό οξείδωσης -1.
* Το υδρογόνο είναι γενικά +1 με μη μέταλλα: Ωστόσο, όταν οι δεσμοί υδρογόνου με μη μέταλλα (στοιχεία στη δεξιά πλευρά του περιοδικού πίνακα), χάνει συνήθως ένα ηλεκτρόνιο και έχει αριθμό οξείδωσης +1. Αυτό οφείλεται στο γεγονός ότι τα μη μέταλλα είναι γενικά πιο ηλεκτροαρχητικά από το υδρογόνο.
* Εξαιρέσεις: Υπάρχουν μερικές εξαιρέσεις σε αυτόν τον γενικό κανόνα. Στα μεταλλικά υδρίδια, το υδρογόνο έχει αριθμό οξείδωσης -1. Επιπλέον, σε ενώσεις όπως το LialH₄ (υδρίδιο αλουμινίου λιθίου), το υδρογόνο έχει αριθμό οξείδωσης -1.
Παραδείγματα αριθμού οξείδωσης υδρογόνου +1 με μη μέταλλα:
* HCl (υδροχλωρικό οξύ): Το υδρογόνο είναι +1, το χλώριο είναι -1.
* h₂o (νερό): Το υδρογόνο είναι +1, το οξυγόνο είναι -2.
* NH₃ (αμμωνία): Το υδρογόνο είναι +1, το άζωτο είναι -3.
Για να κατανοήσετε πλήρως τον αριθμό οξείδωσης του υδρογόνου σε μια συγκεκριμένη ένωση, πρέπει να γνωρίζετε την ταυτότητα του μη μέταλλου που συνδέεται και να εξετάσετε τις διαφορές ηλεκτροαρνητικότητάς τους.