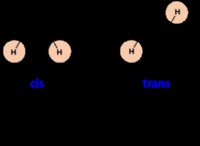
Γιατί οι ιονικές και πολικές ομοιοπολικές ενώσεις σχηματίζουν τα χρυστάλια;
Ιωνικές ενώσεις:
* Ηλεκτροστατική έλξη: Οι ιοντικές ενώσεις σχηματίζονται με τη μεταφορά ηλεκτρονίων από ένα μέταλλο σε ένα μη μέταλλο, δημιουργώντας θετικά φορτισμένα κατιόντα και αρνητικά φορτισμένα ανιόντα. Αυτά τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον έντονα μέσω των ηλεκτροστατικών δυνάμεων, σχηματίζοντας μια άκαμπτη, τρισδιάστατη δομή πλέγματος.
* Κανονική διάταξη: Τα ιόντα οργανώνονται σε ένα πολύ διατεταγμένο και επαναλαμβανόμενο μοτίβο, ελαχιστοποιώντας τις απωθητικές δυνάμεις και μεγιστοποιώντας τις ελκυστικές δυνάμεις. Αυτή η τακτική ρύθμιση δημιουργεί ένα κρυσταλλικό πλέγμα.
* Ισχυρές δυνάμεις: Οι ηλεκτροστατικές δυνάμεις μεταξύ των ιόντων είναι πολύ ισχυρές, οδηγώντας σε υψηλά σημεία τήξης και βρασμού, σκληρότητα και ευγένεια.
πολικές ομοιοπολικές ενώσεις:
* αλληλεπιδράσεις διπόλης-διπόλης: Οι πολικές ομοιοπολικές ενώσεις έχουν μόρια με ανομοιογενή κατανομή ηλεκτρονίων, δημιουργώντας περιοχές μερικής θετικού και μερικού αρνητικού φορτίου (Dipoles). Αυτά τα δίπολα προσελκύουν ο ένας τον άλλον μέσω αλληλεπιδράσεων διπολικής-διπόλης.
* δεσμός υδρογόνου: Σε ορισμένες περιπτώσεις, οι πολικές ομοιοπολικές ενώσεις, ειδικά εκείνες που περιέχουν υδρογόνο που συνδέονται με πολύ ηλεκτροαρνητικά άτομα όπως το οξυγόνο ή το άζωτο, σχηματίζουν ακόμη ισχυρότερους δεσμούς υδρογόνου. Αυτός ο τύπος αλληλεπίδρασης περιλαμβάνει μια ειδική έλξη διπολικού διπόλου όπου ένα άτομο υδρογόνου προσελκύεται από ένα μοναδικό ζεύγος ηλεκτρονίων σε ένα γειτονικό μόριο.
* σχηματισμός κρυστάλλου: Οι αλληλεπιδράσεις διπολικής-διπολικής και οι δεσμοί υδρογόνου είναι αρκετά ισχυροί ώστε να συγκρατούν τα μόρια μαζί σε μια τακτική, επαναλαμβανόμενη διάταξη, οδηγώντας στο σχηματισμό κρυσταλλικού πλέγματος.
Βασικές διαφορές:
* Ιονικά ομόλογα: Οι ιοντικοί κρύσταλλοι έχουν μια ισχυρή, άκαμπτη δομή λόγω των ηλεκτροστατικών δυνάμεων μεταξύ των αντίθετα φορτισμένων ιόντων.
* πολικοί ομοιοπολικοί δεσμοί: Οι πολικοί ομοιοπολικοί κρύσταλλοι είναι γενικά λιγότερο άκαμπτοι από τους ιονικούς κρυστάλλους επειδή οι αλληλεπιδράσεις διπολικής-δίπολης και οι δεσμοί υδρογόνου είναι ασθενέστεροι από τους ιοντικούς δεσμούς. Ωστόσο, η δύναμη αυτών των αλληλεπιδράσεων εξακολουθεί να συμβάλλει στον σχηματισμό μιας κρυσταλλικής δομής.
Συνοπτικά: Τόσο οι ιοντικές όσο και οι πολικές ομοιοπολικές ενώσεις σχηματίζουν κρυστάλλους λόγω των ισχυρών ηλεκτροστατικών δυνάμεων που υπάρχουν μεταξύ των συστατικών σωματιδίων τους. Αυτές οι δυνάμεις συγκρατούν τα σωματίδια σε μια κανονική, επαναλαμβανόμενη διάταξη, δημιουργώντας ένα κρυσταλλικό πλέγμα.