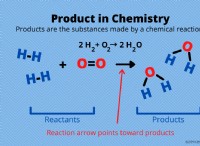
Πώς ξέρετε αν ένα ζευγάρι στοιχεία πρόκειται να αντιδράσει από ένα ιοντικό δεσμό ή ομοιοπολικό δεσμό;
Κατανόηση των βασικών
* Ιονικά ομόλογα: Σχηματίζεται από την ηλεκτροστατική έλξη μεταξύ των αντιθέτων ιόντων. Αυτά τα ιόντα δημιουργούνται όταν ένα άτομο * μεταφέρει * ηλεκτρόνια σε άλλα. Αυτό συμβαίνει μεταξύ μετάλλων και μη μεταλλικών.
* ομοιοπολικοί δεσμοί: Σχηματίζονται όταν δύο άτομα * μοιράζονται τα ηλεκτρόνια για να επιτευχθεί μια σταθερή διαμόρφωση ηλεκτρονίων. Αυτό συμβαίνει συνήθως μεταξύ δύο μη μεταλλικών.
Πρόβλεψη τύπου δεσμού
1. Προσδιορίστε τα στοιχεία: Προσδιορίστε τα στοιχεία που εμπλέκονται στο δεσμό.
2. Εξετάστε την ηλεκτροαρνητικότητα:
* Ηλεκτροργατιστικότητα είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια. Όσο μεγαλύτερη είναι η διαφορά στην ηλεκτροαρνητικότητα μεταξύ δύο ατόμων, τόσο πιο πιθανό είναι να σχηματίσουν έναν ιοντικό δεσμό.
* Χρησιμοποιήστε τον περιοδικό πίνακα ως οδηγό:Η ηλεκτροαρνητικότητα γενικά αυξάνεται σε μια περίοδο (από αριστερά προς τα δεξιά) και μειώνεται κάτω από μια ομάδα (από πάνω προς τα κάτω).
3. Εφαρμόστε τους κανόνες:
* Μεγάλη διαφορά ηλεκτροαρνητικότητας (μεγαλύτερη από 1,7): Ιοντικός δεσμός
* Μικρή διαφορά ηλεκτροαρνητικότητας (μικρότερη από 1,7): Ομοιοπολικό δεσμό
* Διαφορά ηλεκτροαρνητικότητας 0,5 - 1,7: Ο πολικός ομοιοπολικός δεσμός (τα κοινόχρηστα ηλεκτρόνια κατανέμονται άνισα)
Παραδείγματα
* νάτριο (Na) και χλώριο (CL): Το νάτριο έχει χαμηλή ηλεκτροαρνητικότητα, ενώ το χλώριο έχει υψηλή ηλεκτροαρνητικότητα. Η μεγάλη διαφορά στην ηλεκτροαρνητικότητα οδηγεί σε νάτριο * μεταφέροντας * ένα ηλεκτρόνιο στο χλώριο, σχηματίζοντας Na+ και Cl-ions. Αυτό έχει ως αποτέλεσμα ένα ιοντικό δεσμό.
* άνθρακα (c) και οξυγόνο (o): Τόσο ο άνθρακας όσο και το οξυγόνο έχουν σχετικά υψηλές τιμές ηλεκτροαρνητικότητας. Μοιράζονται ηλεκτρόνια για να σχηματίσουν έναν ομοιοπολικό δεσμό σε μόρια όπως το διοξείδιο του άνθρακα (CO2).
Πρόσθετες εκτιμήσεις
* Σύνδεση μετάλλων με μέταλλα: Αυτά συνήθως σχηματίζουν μεταλλικούς δεσμούς, όπου τα ηλεκτρόνια απομακρύνονται σε ένα πλέγμα μεταλλικών ατόμων.
* Πολυατομικά ιόντα: Αυτές είναι ομάδες ατόμων που έχουν καθαρό φορτίο (όπως το θειικό άλας, SO42-). Μπορούν να συμμετάσχουν τόσο σε ιοντική όσο και σε ομοιοπολική συγκόλληση.
Σημαντική σημείωση: Ο κανόνας διαφοράς ηλεκτροαρνητικότητας είναι μια κατευθυντήρια γραμμή. Υπάρχουν εξαιρέσεις και μερικές φορές το πλαίσιο της ένωσης μπορεί να βοηθήσει στον προσδιορισμό του τύπου δεσμού.