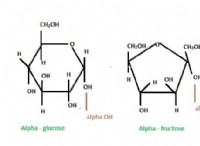
Όταν πολύ ηλεκτροαρνητικά άτομα όπως ο δεσμός οξυγόνου με με χαμηλότερη ηλεκτροαρνητικότητα Hydoge ποιο είναι το αποτέλεσμα;
* Ηλεκτροργατιστικότητα: Το οξυγόνο έχει πολύ υψηλότερη ηλεκτροαρνητικότητα από το υδρογόνο. Αυτό σημαίνει ότι το οξυγόνο έχει ισχυρότερη έλξη στα κοινόχρηστα ηλεκτρόνια του δεσμού.
* Μη εξής κοινή χρήση: Ως αποτέλεσμα, τα κοινόχρηστα ηλεκτρόνια περνούν περισσότερο χρόνο πιο κοντά στο άτομο οξυγόνου, δίνοντάς του ένα μερικό αρνητικό φορτίο (Δ-). Αντιστρόφως, το άτομο υδρογόνου έχει μερικό θετικό φορτίο (Δ+).
* πολικότητα: Η ανομοιόμορφη κατανομή της πυκνότητας ηλεκτρονίων δημιουργεί ένα διαχωρισμό φορτίου μέσα στο μόριο, καθιστώντας τον πολικό δεσμό.
Συνέπειες των πολικών ομοιοπολικών δεσμών:
* δεσμός υδρογόνου: Το μερικό θετικό φορτίο στο υδρογόνο και το μερικό αρνητικό φορτίο στο οξυγόνο στο νερό (H₂O) επιτρέπουν τον σχηματισμό δεσμών υδρογόνου, οι οποίοι είναι ισχυρές ενδομοριακές δυνάμεις που είναι υπεύθυνες για πολλές από τις μοναδικές ιδιότητες του νερού.
* Διαλυτότητα: Τα πολικά μόρια τείνουν να διαλύονται σε πολικούς διαλύτες όπως το νερό, ενώ τα μη πολωτικά μόρια τείνουν να διαλύονται σε μη πολικούς διαλύτες όπως το πετρέλαιο.
* Αντιδραστικότητα: Τα πολικά μόρια είναι συχνά πιο αντιδραστικά από τα μη πολικά μόρια λόγω της παρουσίας μερικών φορτίων.
Παράδειγμα:
Στο νερό (H₂O), το άτομο οξυγόνου τραβά τα κοινά ηλεκτρόνια προς τον εαυτό του, δημιουργώντας ένα μερικό αρνητικό φορτίο στο οξυγόνο και ένα μερικό θετικό φορτίο σε κάθε άτομο υδρογόνου. Αυτή η πολική φύση είναι ζωτικής σημασίας για την ικανότητα του νερού να διαλύει πολλές ουσίες και να συμμετέχει σε πολυάριθμες χημικές αντιδράσεις.