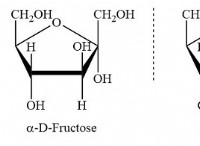
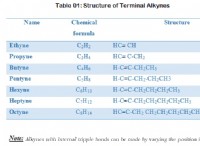
Πώς αναγνωρίζετε μια ιοντική ένωση;
1. Προσδιορίστε τα στοιχεία:
* Metal and Nonetal: Οι ιοντικές ενώσεις συνήθως περιλαμβάνουν ένα μέταλλο (θετικό φορτίο) και ένα μη μέταλλο (αρνητικό φορτίο).
* Παραδείγματα: NaCl (χλωριούχο νάτριο), CaO (οξείδιο του ασβεστίου), MgCl₂ (χλωριούχο μαγνήσιο)
* Πολυατομικά ιόντα: Αυτές είναι ομάδες ατόμων με συνολικό θετικό ή αρνητικό φορτίο.
* Παραδείγματα: NH₄CL (χλωριούχο αμμωνίου), Na₂so₄ (θειικό νάτριο)
2. Ψάξτε για κατιόντα και ανιόντα:
* ΚΟΟΔΙΑ: Θετικά φορτισμένα ιόντα (μέταλλα ή πολυατομικά ιόντα).
* Anions: Αρνητικά φορτισμένα ιόντα (μη μέταλλα ή πολυατομικά ιόντα).
3. Ελέγξτε για ηλεκτροστατική έλξη:
* Οι ιοντικές ενώσεις σχηματίζονται από την ισχυρή ηλεκτροστατική έλξη μεταξύ αντίθετα φορτισμένων ιόντων. Αυτή η έλξη είναι η κύρια δύναμη που συγκρατεί την ένωση μαζί.
4. Εξετάστε τις ιδιότητες:
* υψηλά σημεία τήξης και βρασμού: Οι ισχυρές ηλεκτροστατικές δυνάμεις απαιτούν πολλή ενέργεια για να σπάσουν.
* Κρυσταλλική δομή: Οι ιοντικές ενώσεις συχνά σχηματίζουν τακτικές, επαναλαμβανόμενες δομές στη στερεά τους μορφή.
* καλοί αγωγοί στην τετηγμένη ή διαλυμένη κατάσταση: Όταν λιωθεί ή διαλυθεί, τα ιόντα γίνονται ελεύθερα να μετακινούνται και να μεταφέρουν ηλεκτρικό ρεύμα.
5. Εξαιρέσεις και ειδικές περιπτώσεις:
* Ορισμένες ενώσεις με μέταλλο και μη μέταλλο μπορεί να είναι ομοιοπολικές: Τα μεταβατικά μέταλλα μπορούν να σχηματίσουν ομοιοπολικές ενώσεις με μη μέταλλα, ειδικά όταν υπάρχει μικρή διαφορά στην ηλεκτροαρνητικότητα.
* Ορισμένες ενώσεις με μη μέταλλο και μη μέταλλο μπορεί να είναι ιοντικές: Για παράδειγμα, το χλωριούχο αμμωνίου (NH₄Cl) είναι ιοντικό, παρόλο που έχει δύο μη μέταλλα.
Συνοπτικά:
* Η παρουσία ενός μετάλλου και ενός μη μεταλλικού, ο σχηματισμός κατιόντων και ανιόντων και η ισχυρή ηλεκτροστατική έλξη μεταξύ τους αποτελούν βασικούς δείκτες μιας ιοντικής ένωσης.
* Επιπλέον, οι ιδιότητες των υψηλών σημείων τήξης/βρασμού, της κρυσταλλικής δομής και της αγωγιμότητας στην τετηγμένη ή διαλυμένη κατάσταση επιβεβαιώνουν περαιτέρω την ιοντική φύση.