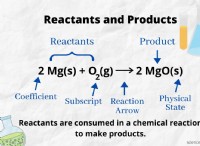
Τι συμβαίνει όταν η σκόνη ψευδαργύρου προστίθεται σε ένα οξινισμένο διάλυμα υπερμαγγανικού καλίου;
1. Αντίδραση οξειδοαναγωγής:
* ψευδάργυρος (zn) οξειδώνεται, χάνει ηλεκτρόνια και σχηματίζοντας ιόντα ψευδαργύρου (zn²⁺) .
* ιόντα υπερμαγγανικού (Mno₄⁻) μειώνονται, κερδίζοντας ηλεκτρόνια και σχηματίζοντας ιόντα μαγγανίου (Mn²⁺) .
2. Η αντίδραση:
Η συνολική αντίδραση μπορεί να εκπροσωπηθεί ως:
2kmno₄ + 5zn + 8h⁺ → k₂so₄ + 5zn²⁺ + 2mn2⁺ + 8h₂o
3. Παρατηρήσεις:
* Μωβ χρώμα εξαφανίζεται: Το χαρακτηριστικό μοβ χρώμα του υπερμαγγανικού καλίου εξασθενεί καθώς μειώνεται τα ιόντα υπερμαγγανικού.
* Εξέλιξη αερίου: Το αέριο υδρογόνου απελευθερώνεται λόγω της αντίδρασης του οξέος με ψευδάργυρο.
* Η λύση γίνεται άχρωμη: Τελικά, το διάλυμα γίνεται άχρωμο, καθώς τα ιόντα μαγγανίου σχηματίζουν ένα ανοιχτό ροζ διάλυμα.
* Δημιουργία θερμότητας: Η αντίδραση είναι εξωθερμική, οπότε η λύση θα ζεσταθεί.
4. Βασικά σημεία:
* Η οξίνιση είναι κρίσιμη: Το οξύ παρέχει ιόντα υδρογόνου (Η) τα οποία είναι απαραίτητα για τη μείωση των ιόντων υπερμαγγανικού.
* Η σκόνη ψευδαργύρου αντιδρά εύκολα: Η σκόνη ψευδαργύρου είναι μια λεπτή διαιρεμένη μορφή ψευδαργύρου που αυξάνει την επιφάνεια για επαφή, καθιστώντας την αντίδραση ταχύτερη.
Συνοπτικά, η αντίδραση μεταξύ της σκόνης ψευδαργύρου και ενός οξυμένου διαλύματος υπερμαγγανικού καλίου είναι μια οξειδοαναγωγική αντίδραση όπου ο ψευδάργυρος οξειδώνεται και τα ιόντα υπερμαγγανικού άλατος μειώνονται, με αποτέλεσμα μια έντονη αντίδραση με αλλαγές χρώματος, εξέλιξη αερίου και παραγωγή θερμότητας.