Τι είναι ένα αντιδρών στη χημεία; Ορισμός και Παραδείγματα
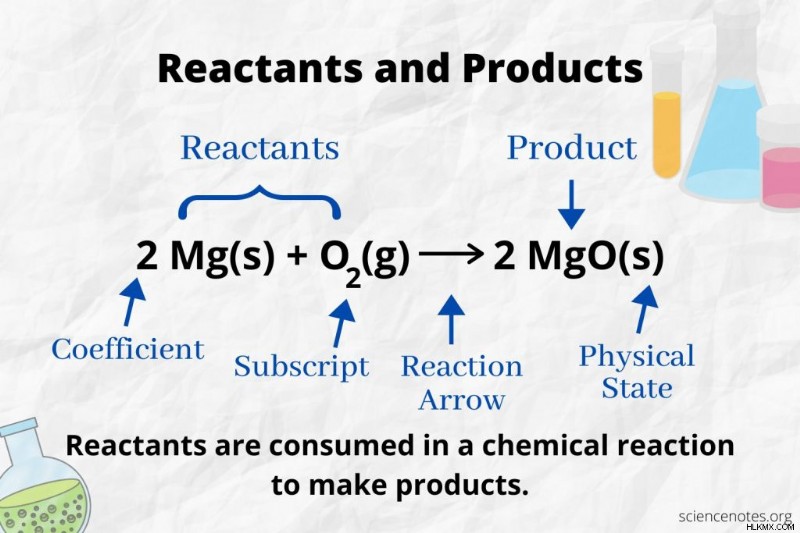
Στη χημεία, ένα αντιδρών είναι μια πρώτη ύλη σε μια χημική αντίδραση που καταναλώνεται για να σχηματίσει προϊόντα. Η ενέργεια ενεργοποίησης που απαιτείται για την έναρξη μιας χημικής αντίδρασης σπάει τους δεσμούς μεταξύ των ατόμων των αντιδρώντων. Το αντιδραστήριο υφίσταται μια χημική αλλαγή, σχηματίζοντας νέους δεσμούς που καταλήγουν σε προϊόντα. Ο όρος «αντιδρών» χρησιμοποιήθηκε για πρώτη φορά γύρω στο 1900 έως το 1920.
Παραδείγματα αντιδρώντων
Τα αντιδρώντα είναι αυτά με τα οποία ξεκινάτε σε μια αντίδραση. Είναι διαφορετικά από αυτά που λαμβάνετε μετά την εμφάνιση της αντίδρασης. Οποιαδήποτε χημική αλλαγή περιλαμβάνει αντιδρώντα και προϊόντα.
- Το κερί ενός κεριού και το οξυγόνο στον αέρα είναι αντιδραστήρια σε μια αντίδραση καύσης. Τα προϊόντα είναι διοξείδιο του άνθρακα και υδρατμοί.
- Όταν καίτε αέριο μεθάνιο, τα αντιδρώντα είναι μεθάνιο (CH4 ) και το οξυγόνο στον αέρα (O2 ). Τα προϊόντα της αντίδρασης είναι το διοξείδιο του άνθρακα (CO2 ) και νερό (H2 O).
- Όταν σχηματίζεται νερό από τα στοιχεία του, τα αντιδρώντα είναι υδρογόνο (H2 ) και οξυγόνο (O2 ) αέριο. Το προϊόν είναι νερό (H2 O).
- Στη φωτοσύνθεση, τα αντιδρώντα είναι το διοξείδιο του άνθρακα (CO2 ) και νερό (H2 Ο). Το προϊόν είναι γλυκόζη (C6 H12 O6 ). Σημειώστε ότι το ηλιακό φως δεν θεωρείται αντιδρών. Τα αντιδρώντα είναι ύλη (άτομα, μόρια, ιόντα), όχι ενέργεια.
Προσδιορισμός αντιδρώντων και προϊόντων σε χημικές εξισώσεις
Κοιτάξτε το βέλος της αντίδρασης για να αναγνωρίσετε τα αντιδρώντα και τα προϊόντα σε μια χημική εξίσωση. Σε μια αντίδραση που προχωρά μόνο προς την κατεύθυνση προς τα εμπρός, το βέλος δείχνει από αριστερά προς τα δεξιά. Τα αντιδρώντα βρίσκονται στα αριστερά του βέλους, ενώ τα προϊόντα στα δεξιά του βέλους. Εάν κάποια χημικά είδη παρατίθενται και στις δύο πλευρές της εξίσωσης (π.χ. ιόντα διαλύτη ή θεατή), δεν είναι ούτε αντιδρώντα ούτε προϊόντα.
Στην ακόλουθη αντίδραση, τα Α και Β είναι αντιδρώντα και το C είναι το προϊόν:
A + B → C
Ωστόσο, δεν χρειάζεται να υπάρχουν περισσότερα από ένα αντιδρώντα. Σε αυτή την αντίδραση, το Α είναι το αντιδρών, ενώ το Β και το Γ είναι προϊόντα:
A → B + C
Ο αριθμός και ο τύπος των ατόμων είναι ο ίδιος για τα προϊόντα και τα αντιδρώντα σε μια ισορροπημένη χημική εξίσωση. Για παράδειγμα, ο αριθμός των ατόμων υδρογόνου και οξυγόνου είναι ο ίδιος για τα αντιδρώντα (H2 και O2 ) και το προϊόν (H2 O).
2 H2 (ζ) + O2 (ζ) → 2 H2 O(l)
Ο αριθμός κάθε τύπου ατόμου είναι ο συντελεστής του πολλαπλασιασμένος με τον δείκτη του (ή επί 1 εάν δεν αναφέρεται κανένας συντελεστής ή δείκτης). Έτσι, υπάρχουν 4 άτομα υδρογόνου στην πλευρά του αντιδρώντος (2 x 2) και 2 άτομα οξυγόνου (1 x 2). Υπάρχουν 4 άτομα υδρογόνου στην πλευρά του προϊόντος (2 x 2) και 2 άτομα οξυγόνου (2 x 1). Η κατάσταση της ύλης (s =στερεό, l =υγρό, g =αέριο, υδατικό =υδατικό ή διαλυμένο σε νερό) δηλώνεται σύμφωνα με κάθε χημικό τύπο.
Πολλές αντιδράσεις προχωρούν και προς τις δύο κατευθύνσεις για να φτάσουν σε κατάσταση ισορροπίας. Και εδώ, το βέλος αντίδρασης προσδιορίζει τα αντιδρώντα και τα προϊόντα, αλλά το βέλος δείχνει και τις δύο κατευθύνσεις! Σε αυτόν τον τύπο αντίδρασης, τα χημικά είδη σε κάθε πλευρά της αντίδρασης είναι και αντιδρώντα και προϊόντα.
Ένα παράδειγμα είναι η διαδικασία Haber, η οποία σχηματίζει αμμωνία από άζωτο και οξυγόνο:
N2 (ζ) + 3Η2 (ζ) ⇌ 2NH3 (ζ)
Η αντίδραση θα μπορούσε εύκολα να γραφτεί:
2NH3 (ζ) ⇌ N2 (ζ) + 3Η2 (ζ)
Η σταθερά ισορροπίας για την αντίδραση δείχνει πόσο έντονα δείχνει το βέλος τη μία κατεύθυνση έναντι της άλλης, αλλά δεν φαίνεται στην εξίσωση.
Διαφορά μεταξύ αντιδραστηρίου και αντιδραστηρίου
Στην κοινή χρήση, οι όροι «αντιδραστήριο» και «αντιδραστήριο» χρησιμοποιούνται εναλλακτικά. Τεχνικά, οι δύο λέξεις έχουν διαφορετική σημασία. Στην αναλυτική χημεία, ένα αντιδραστήριο είναι μια ουσία που προστίθεται για να προκαλέσει μια χημική αντίδραση ή να ελέγξει εάν έχει συμβεί. Τα αντιδραστήρια δεν καταναλώνονται απαραίτητα σε μια αντίδραση.
Ομοίως, διαλύτες, καταλύτες και υποστρώματα μπορεί να εμπλέκονται σε μια αντίδραση, αλλά δεν θεωρούνται ούτε αντιδραστήρια ούτε προϊόντα.
Αναφορές
- IUPAC (1997) "Reactant". Επιτομή Χημικής Ορολογίας (το «Χρυσό Βιβλίο»). Επιστημονικές Εκδόσεις Blackwell. ISBN 0-9678550-9-8. doi:10.1351/goldbook




