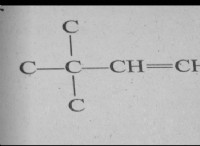
Ποια χημική κινητική;
Χημική κινητική:Η μελέτη των ρυθμών αντίδρασης
Η χημική κινητική είναι ο κλάδος της χημείας που διερευνά τα ποσοστά και τους μηχανισμούς των χημικών αντιδράσεων. Βυθίζεται στο πόσο γρήγορα προχωράει μια αντίδραση και η διαδικασία βήμα προς βήμα με την οποία τα αντιδραστήρια μετατρέπονται σε προϊόντα.
Ακολουθεί μια κατανομή των βασικών πτυχών της χημικής κινητικής:
1. Ρυθμός αντίδρασης:
* Μετράει πόσο γρήγορα καταναλώνονται τα αντιδραστήρια ή πόσο γρήγορα σχηματίζονται προϊόντα.
* Συχνά εκφράζεται ως μεταβολή της συγκέντρωσης ενός αντιδραστηρίου ή ενός προϊόντος με την πάροδο του χρόνου.
* Μπορεί να επηρεαστεί από παράγοντες όπως η θερμοκρασία, η συγκέντρωση, η επιφάνεια και οι καταλύτες.
2. Νόμος βαθμού:
* Μια μαθηματική εξίσωση που σχετίζεται με τον ρυθμό αντίδρασης στις συγκεντρώσεις των αντιδραστηρίων.
* Παρέχει πληροφορίες σχετικά με τη μοριακή ικανότητα της αντίδρασης (πόσα μόρια εμπλέκονται στο βήμα προσδιορισμού του ρυθμού).
* Βοηθά στην πρόβλεψη του τρόπου με τον οποίο οι μεταβαλλόμενες συγκεντρώσεις αντιδραστηρίου θα επηρεάσουν τον ρυθμό αντίδρασης.
3. Μηχανισμός αντίδρασης:
* Μια λεπτομερής περιγραφή βήμα προς βήμα για το πώς συμβαίνει μια αντίδραση.
* Δείχνει το σχηματισμό ενδιάμεσων, τη συμμετοχή των καταλυτών και την ακολουθία των στοιχειωδών βημάτων.
* Εξηγεί γιατί ορισμένες αντιδράσεις είναι γρήγορες και άλλες είναι αργές.
4. Ενέργεια ενεργοποίησης:
* Η ελάχιστη ποσότητα ενέργειας που απαιτείται για τα αντιδραστήρια να συγκρουστούν και να σχηματίσουν προϊόντα.
* Μια υψηλότερη ενέργεια ενεργοποίησης υποδεικνύει μια βραδύτερη αντίδραση.
* Μπορεί να μειωθεί χρησιμοποιώντας καταλύτες, οι οποίοι παρέχουν εναλλακτικές οδούς με χαμηλότερες ενέργειες ενεργοποίησης.
5. Εξάρτηση θερμοκρασίας:
* Η αύξηση της θερμοκρασίας αυξάνει γενικά τον ρυθμό αντίδρασης.
* Αυτό οφείλεται στο γεγονός ότι οι υψηλότερες θερμοκρασίες οδηγούν σε συχνότερες και ενεργητικές συγκρούσεις, γεγονός που αυξάνει την πιθανότητα επιτυχημένων αντιδράσεων.
Γιατί η χημική κινητική είναι σημαντική;
* Πρόβλεψη ρυθμών αντίδρασης: Βοηθά στο σχεδιασμό και τη βελτιστοποίηση των χημικών διεργασιών, όπως η βιομηχανική σύνθεση ή η ανάπτυξη φαρμάκων.
* Κατανόηση μηχανισμών αντίδρασης: Επιτρέπει τον έλεγχο και τον χειρισμό των αντιδράσεων προσδιορίζοντας τα στάδια καθορισμού του ρυθμού και τις πιθανές συμφόρηση.
* Ανάπτυξη νέων καταλυτών: Οδηγεί στην ανάπτυξη πιο αποτελεσματικών και φιλικών προς το περιβάλλον χημικών διεργασιών.
Παραδείγματα εφαρμογών:
* Διατήρηση τροφίμων: Η κατανόηση της κινητικής της αλλοίωσης των τροφίμων βοηθά στην ανάπτυξη μεθόδων για την επέκταση της διάρκειας ζωής.
* Ανάπτυξη φαρμάκων: Η μελέτη του μεταβολισμού των φαρμάκων και των ποσοστών αποικοδόμησης εξασφαλίζει την αποτελεσματικότητα και την ασφάλεια.
* Περιβαλλοντική χημεία: Η ανάλυση της κινητικής των ατμοσφαιρικών αντιδράσεων βοηθά στην κατανόηση της ρύπανσης και των αποτελεσμάτων της.
Συμπερασματικά, η χημική κινητική είναι ένα θεμελιώδες πεδίο χημείας που παρέχει μια βαθιά κατανόηση του τρόπου με τον οποίο συμβαίνουν οι αντιδράσεις και πώς μπορούν να επηρεαστούν τα ποσοστά τους. Έχει ευρείες εφαρμογές σε διάφορους τομείς, συμβάλλοντας στην πρόοδο της ιατρικής, της βιομηχανίας και της περιβαλλοντικής επιστήμης.