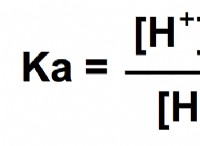Πώς η αύξηση της θερμοκρασίας αλλάζει τη σταθερά ταχύτητας μιας χημικής αντίδρασης;
* Θεωρία σύγκρουσης: Οι αντιδράσεις εμφανίζονται όταν τα μόρια αντιδραστηρίων συγκρούονται με αρκετή ενέργεια για να σπάσουν τους υπάρχοντες δεσμούς και να σχηματίσουν νέες. Οι υψηλότερες θερμοκρασίες σημαίνει ότι τα μόρια κινούνται ταχύτερα και συγκρούονται συχνότερα με μεγαλύτερη δύναμη.
* Ενέργεια ενεργοποίησης: Κάθε αντίδραση έχει ενέργεια ενεργοποίησης (ΕΑ), την ελάχιστη ενέργεια που απαιτείται για μια επιτυχημένη σύγκρουση. Η αυξημένη θερμοκρασία παρέχει περισσότερα μόρια με επαρκή ενέργεια για να ξεπεραστεί η ΕΑ, οδηγώντας σε πιο επιτυχημένες συγκρούσεις και ταχύτερη αντίδραση.
* Εξίσωση Arrhenius: Η σχέση μεταξύ θερμοκρασίας και σταθεράς ρυθμού περιγράφεται από την εξίσωση Arrhenius:
`` `
k =a * exp (-ea / (r * t))
`` `
όπου:
* k είναι η σταθερά ρυθμού
* A είναι ο προ-εκθετικός παράγοντας (που σχετίζεται με τη συχνότητα σύγκρουσης)
* Η EA είναι η ενέργεια ενεργοποίησης
* R είναι η ιδανική σταθερά αερίου
* T είναι η απόλυτη θερμοκρασία
Αυτή η εξίσωση δείχνει ότι το Κ αυξάνεται εκθετικά με την αύξηση της θερμοκρασίας.
Συνοπτικά:
* Η υψηλότερη θερμοκρασία οδηγεί σε περισσότερες συγκρούσεις με μεγαλύτερη ενέργεια.
* Περισσότερα μόρια έχουν αρκετή ενέργεια για να ξεπεράσουν το φράγμα ενεργειακής ενεργοποίησης.
* Η σταθερά ρυθμού (k) αυξάνεται, με αποτέλεσμα ταχύτερο ρυθμό αντίδρασης.
Σημαντική σημείωση: Ενώ η αύξηση της θερμοκρασίας συνήθως επιταχύνει μια αντίδραση, υπάρχουν εξαιρέσεις:
* Αντιδράσεις ισορροπίας: Ορισμένες αντιδράσεις είναι αναστρέψιμες και η αύξηση της θερμοκρασίας μπορεί να μετατοπίσει τη θέση ισορροπίας, ενδεχομένως μειώνοντας τον ρυθμό της αντίδρασης προς τα εμπρός.
* σύνθετες αντιδράσεις: Σε αντιδράσεις πολλαπλών σταδίων, η αύξηση της θερμοκρασίας μπορεί να επηρεάσει διαφορετικά τα ποσοστά των μεμονωμένων βημάτων, ενδεχομένως να οδηγούν σε απροσδόκητα συνολικά αποτελέσματα.