Πώς οι χημικοί άλλαξαν τον περιοδικό πίνακα στις αρχές της δεκαετίας του 1900;
1. Ο ρόλος του ατομικού αριθμού:
* Ο αρχικός πίνακας του Mendeleev (1869) βασίστηκε στην ατομική μάζα Ωστόσο, υπήρξαν κάποιες ασυνέπειες και αποκλίσεις.
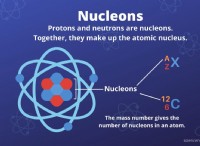
* Το έργο του Henry Moseley (1913) χρησιμοποιώντας φασματοσκοπία ακτίνων Χ καθορίζει τον ατομικό αριθμό κάθε στοιχείου. Ο ατομικός αριθμός, που αντιπροσωπεύει τον αριθμό των πρωτονίων σε έναν πυρήνα του ατόμου, ήταν μια πιο θεμελιώδης ιδιοκτησία από την ατομική μάζα.
* Ο περιοδικός πίνακας αναδιοργανώθηκε με βάση τον ατομικό αριθμό. Αυτό λύνει τις αποκλίσεις και τις ασυνέπειες στο τραπέζι του Mendeleev, δημιουργώντας μια σαφέστερη και πιο λογική σειρά.
2. Κατανόηση των ισότοπων:
* Ο Frederick Soddy (1913) ανακάλυψε ισότοπα - άτομα του ίδιου στοιχείου με διαφορετικές ατομικές μάζες. Αυτό εξήγησε γιατί ορισμένα στοιχεία είχαν ελαφρώς διαφορετικά ατομικά βάρη και γιατί η προηγούμενη παραγγελία με ατομική μάζα δεν λειτούργησε πάντα.
* Η έννοια των ισότοπων βοήθησε να βελτιωθεί η κατανόηση της ατομικής δομής και του περιοδικού πίνακα.
3. Η κβαντική επανάσταση:
* Το μοντέλο Niels Bohr του Atom (1913) εξήγησε τη διάταξη των ηλεκτρονίων σε επίπεδα ενέργειας.
* Αυτό το μοντέλο, μαζί με την ανάπτυξη της κβαντικής μηχανικής, παρείχε μια βαθύτερη κατανόηση της χημικής συμπεριφοράς των στοιχείων και των περιοδικών τάσεων.
* Ο περιοδικός πίνακας έγινε περισσότερο από ένα απλό οργανωτικό εργαλείο. αντικατοπτρίζει την υποκείμενη κβαντική δομή των ατόμων.
4. Νέα στοιχεία:
* Η ανάπτυξη της πυρηνικής φυσικής και η ανακάλυψη της ραδιενέργειας οδήγησαν στη δημιουργία νέων στοιχείων.
* Αυτά τα νέα στοιχεία, όπως το protactinium και το ουράνιο, προστέθηκαν στον περιοδικό πίνακα, επεκτείνοντας περαιτέρω το πεδίο εφαρμογής του.
5. Ο σύγχρονος περιοδικός πίνακας:
* Μέχρι τη δεκαετία του 1930, ο περιοδικός πίνακας είχε αναλάβει τη σύγχρονη μορφή του, που διοργανώθηκε από ατομικό αριθμό και ενσωματώνει τις τελευταίες επιστημονικές ανακαλύψεις.
* Αυτή η δομή, με βάση την ατομική δομή και την κβαντική φύση των ηλεκτρονίων, έγινε το θεμελιώδες πλαίσιο για την κατανόηση των χημικών ιδιοτήτων και των σχέσεων μεταξύ των στοιχείων.
Συνοπτικά, οι αρχές της δεκαετίας του 1900 είδαν έναν σημαντικό μετασχηματισμό στην κατανόηση του περιοδικού πίνακα. Οι χημικοί μετακινήθηκαν από μια ρύθμιση που βασίζεται στην ατομική μάζα σε μία με βάση τον ατομικό αριθμό, ενσωμάτωσε την έννοια των ισότοπων και ενσωμάτωσε τις ιδέες της κβαντικής μηχανικής για να δημιουργήσει μια πιο ακριβή και διορατική αναπαράσταση των στοιχείων. Αυτή η μετατόπιση όχι μόνο αναδιοργάνωσε τα στοιχεία, αλλά έδωσε επίσης μια πιο θεμελιώδη κατανόηση της χημικής τους συμπεριφοράς και της φύσης της ίδιας της ύλης.