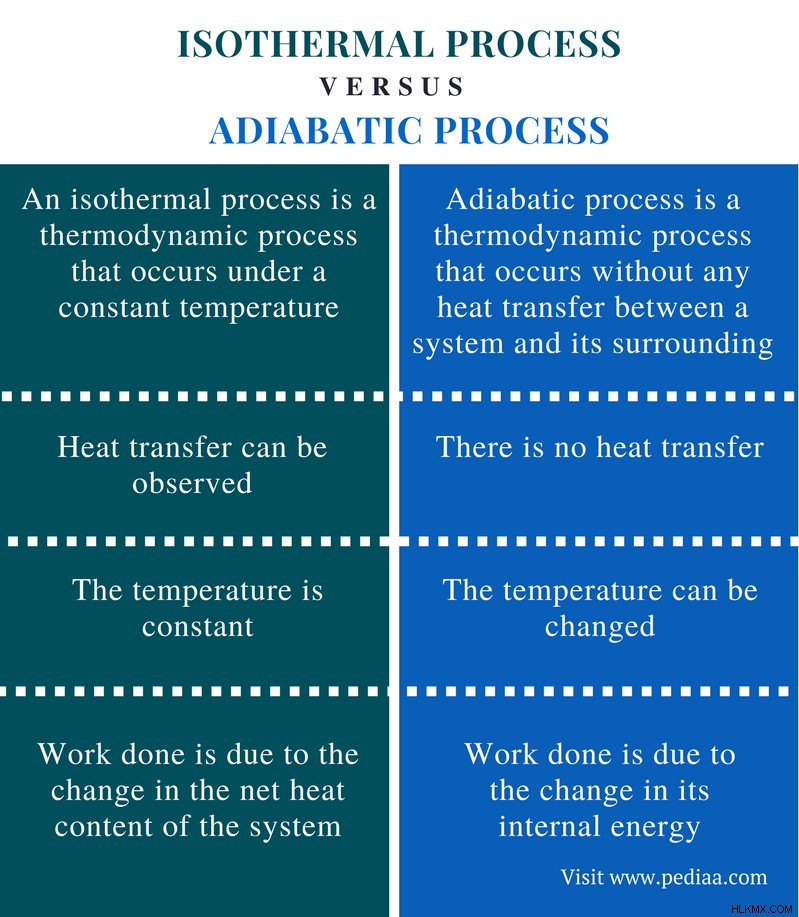
Διαφορά μεταξύ ισοθερμικής και αδιαβατικής διαδικασίας
Κύρια διαφορά – Ισοθερμική έναντι αδιαβατικής διαδικασίας
Η Θερμοδυναμική χρησιμοποιεί τις έννοιες ισοθερμική διεργασία και αδιαβατική διεργασία για να εξηγήσει τη συμπεριφορά ενός θερμοδυναμικού συστήματος και τη σχέση του με τις αλλαγές θερμοκρασίας. Η ισοθερμική διαδικασία είναι μια διαδικασία που συμβαίνει σε σταθερή θερμοκρασία, αλλά άλλες παράμετροι σχετικά με το σύστημα μπορούν να αλλάξουν ανάλογα. Η αδιαβατική διεργασία περιγράφει μια διαδικασία όπου δεν πραγματοποιείται μεταφορά θερμότητας μεταξύ ενός συστήματος και του περιβάλλοντός του. Εδώ, η θερμοκρασία του συστήματος θα πρέπει να αλλάξει για να αποφευχθεί οποιαδήποτε μεταφορά θερμότητας. Αυτό υποδηλώνει ότι η κύρια διαφορά μεταξύ ισοθερμικής και αδιαβατικής διεργασίας είναι ότι ισόθερμη διεργασία λαμβάνει χώρα υπό σταθερή θερμοκρασία ενώ η αδιαβατική διεργασία λαμβάνει χώρα υπό μεταβαλλόμενη θερμοκρασία.
Βασικές περιοχές που καλύπτονται
1. Τι είναι μια Ισοθερμική Διαδικασία
– Ορισμός, Χαρακτηριστικά Χαρακτηριστικά
2. Τι είναι η αδιαβατική διαδικασία
– Ορισμός, Χαρακτηριστικά Χαρακτηριστικά
3. Ποια είναι η διαφορά μεταξύ ισοθερμικής και αδιαβατικής διαδικασίας
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αδιαβατική διεργασία, Ισοθερμική διεργασία, Περιβάλλον, Σύστημα, Θερμοδυναμικό Σύστημα
Τι είναι μια Ισοθερμική Διεργασία
Μια ισοθερμική διεργασία είναι μια θερμοδυναμική διεργασία που λαμβάνει χώρα υπό σταθερή θερμοκρασία. Αυτό σημαίνει ότι μια ισοθερμική διαδικασία συμβαίνει σε ένα σύστημα όπου η θερμοκρασία είναι σταθερή. Προκειμένου να διατηρείται σταθερή η θερμοκρασία του συστήματος, η θερμότητα θα πρέπει να μεταφέρεται έξω από το σύστημα ή μέσα στο σύστημα.
Εκτός αυτού, ορισμένοι άλλοι παράγοντες του συστήματος αλλάζουν επίσης κατά την εξέλιξη μιας ισοθερμικής διαδικασίας όπως η εσωτερική ενέργεια. Για να διατηρηθεί η θερμοκρασία του συστήματος, μπορεί να διατηρηθεί σε λουτρό θερμότητας. Στη συνέχεια, ρυθμίζοντας τη θερμοκρασία του θερμικού λουτρού, μπορούμε να ελέγξουμε τη θερμοκρασία του συστήματος σε ένα κατάλληλο επίπεδο.
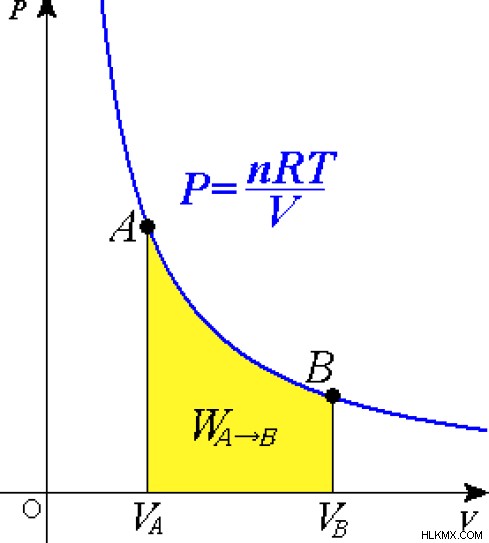
Εικόνα 1:Μια καμπύλη για μια ισοθερμική διεργασία σχετικά με ένα ιδανικό αέριο.
Παραδείγματα ισοθερμικών διεργασιών περιλαμβάνουν αλλαγή φάσης της ύλης, τήξη ύλης, εξάτμιση κ.λπ. Μια βιομηχανική χρήση της ισοθερμικής διεργασίας είναι η μηχανή θερμότητας carnot. Για να διατηρηθεί η θερμοκρασία του συστήματος, θα πρέπει είτε να γίνει εργασία στο σύστημα είτε από το σύστημα στο περιβάλλον. η εκτέλεση εργασιών στο αέριο αυξάνει την εσωτερική ενέργεια και η θερμοκρασία αυξάνεται. Αλλά εάν η θερμοκρασία είναι υψηλότερη από το απαιτούμενο επίπεδο, τότε η εργασία γίνεται από το σύστημα στο περιβάλλον. Στη συνέχεια η θερμοκρασία του συστήματος μειώνεται αφού η ενέργεια απελευθερώνεται στο περιβάλλον ως θερμότητα.
Τι είναι μια αδιαβατική διαδικασία
Η αδιαβατική διεργασία είναι μια θερμοδυναμική διεργασία που λαμβάνει χώρα χωρίς καμία μεταφορά θερμότητας μεταξύ ενός συστήματος και του περιβάλλοντός του. Εδώ, είτε θερμότητα είτε ύλη δεν μεταφέρεται μέσα ή έξω από το σύστημα. Επομένως, στην αδιαβατική διαδικασία, ο μόνος τρόπος μεταφοράς ενέργειας μεταξύ ενός συστήματος και του περιβάλλοντός του είναι ως έργο.
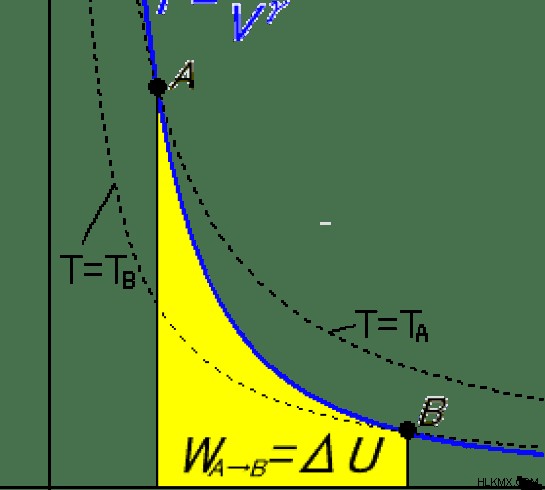
Εικόνα 2:Μια αδιαβατική διαδικασία
Μια αδιαβατική διαδικασία μπορεί να διατηρηθεί εκτελώντας γρήγορα τη διαδικασία. Για παράδειγμα, εάν συμπιέσουμε γρήγορα ένα αέριο σε έναν κύλινδρο, δεν υπάρχει αρκετός χρόνος για το σύστημα να μεταφέρει θερμική ενέργεια στο περιβάλλον. Στις αδιαβατικές διεργασίες, η εργασία που γίνεται από το σύστημα αλλάζει την εσωτερική ενέργεια του συστήματος.
Διαφορά μεταξύ ισοθερμικής και αδιαβατικής διεργασίας
Ορισμός
Ισοθερμική διαδικασία: Μια ισοθερμική διεργασία είναι μια θερμοδυναμική διαδικασία που λαμβάνει χώρα υπό σταθερή θερμοκρασία.
Αδιαβατική διαδικασία: Η αδιαβατική διεργασία είναι μια θερμοδυναμική διαδικασία που λαμβάνει χώρα χωρίς καμία μεταφορά θερμότητας μεταξύ ενός συστήματος και του περιβάλλοντός του.
Μεταφορά θερμότητας
Ισοθερμική διαδικασία: Η μεταφορά θερμότητας μπορεί να παρατηρηθεί σε ισοθερμικές διεργασίες.
Αδιαβατική διαδικασία: Δεν υπάρχει μεταφορά θερμότητας στις αδιαβατικές διεργασίες.
Θερμοκρασία
Ισοθερμική διαδικασία: Η θερμοκρασία είναι σταθερή για ισοθερμικές διεργασίες.
Αδιαβατική διαδικασία: Η θερμοκρασία μπορεί να αλλάξει σε αδιαβατικές διεργασίες.
Εργασία
Ισοθερμική διαδικασία: Στις ισοθερμικές διεργασίες, η εργασία που γίνεται οφείλεται στην αλλαγή της καθαρής θερμικής περιεκτικότητας του συστήματος.
Αδιαβατική διαδικασία: Στις αδιαβατικές διεργασίες, το έργο που γίνεται οφείλεται στην αλλαγή της εσωτερικής του ενέργειας.
Συμπέρασμα
Οι ισοθερμικές και αδιαβατικές διεργασίες είναι θερμοδυναμικές διεργασίες. Αυτές οι διαδικασίες περιγράφουν τη σχέση μεταξύ της εσωτερικής ενέργειας ενός συστήματος και των αλλαγών του. Η κύρια διαφορά μεταξύ της ισοθερμικής και της αδιαβατικής διεργασίας είναι ότι η ισοθερμική διεργασία λαμβάνει χώρα υπό σταθερή θερμοκρασία ενώ η αδιαβατική διεργασία λαμβάνει χώρα υπό μεταβαλλόμενη θερμοκρασία.




