Γιατί μερικές ενώσεις δεν έχουν καμία χρέωση;
1. Ομοιοπολική συγκόλληση:
* Η κοινή χρήση είναι φροντίδα: Σε ομοιοπολικούς δεσμούς, τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν σταθερή διαμόρφωση ηλεκτρονίων. Όταν η κοινή χρήση είναι ίση, κάθε άτομο "κατέχει" το ήμισυ των κοινόχρηστων ηλεκτρονίων.
* ίση κοινή χρήση: Αυτή η ίση κοινή χρήση συμβαίνει όταν τα εμπλεκόμενα άτομα έχουν παρόμοια ηλεκτροαρνητικότητα. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε έναν δεσμό. Εάν τα άτομα έχουν παρόμοια ηλεκτροαγγειότητα, τραβούν τα κοινόχρηστα ηλεκτρόνια με ίση δύναμη, με αποτέλεσμα να μην έχει καθαρή φόρτιση στο μόριο.
* Παραδείγματα: Νερό (H₂O), μεθάνιο (CH₄), διοξείδιο του άνθρακα (CO₂).
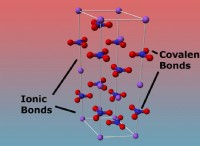
2. Ιωνικές ενώσεις:
* Μεταφορά ηλεκτρονίων: Οι ιοντικές ενώσεις σχηματίζονται όταν ένα άτομο (τυπικά ένα μέταλλο) χάνει ηλεκτρόνια και ένα άλλο άτομο (τυπικά μη μέταλλο) κερδίζει αυτά τα ηλεκτρόνια. Αυτό δημιουργεί θετικά φορτισμένα ιόντα (κατιόντα) και αρνητικά φορτισμένα ιόντα (Anions).
* εξουδετέρωση: Σε μια σταθερή ιοντική ένωση, τα φορτία των κατιόντων και των ανιόντων εξισορροπούνται, με αποτέλεσμα μια ουδέτερη ένωση.
* Παράδειγμα: Χλωριούχο νάτριο (NaCl), όπου το νάτριο χάνει ένα ηλεκτρόνιο για να γίνει Na⁺ και χλωρίνη κερδίζει ένα ηλεκτρόνιο για να γίνει CL⁻.
3. Άλλοι παράγοντες:
* Πολυατομικά ιόντα: Ορισμένα μόρια, παρόλο που αποτελούνται από πολλαπλά άτομα, μπορούν να έχουν καθαρή χρέωση. Αυτά ονομάζονται πολυατομικά ιόντα. Παραδείγματα περιλαμβάνουν θειικό άλας (SO₄2⁻) και αμμωνίο (NH₄⁺).
* Συνολική χρέωση: Είναι σημαντικό να εξεταστεί η συνολική φόρτιση μιας ένωσης. Ενώ τα μεμονωμένα άτομα μέσα σε μια ένωση μπορεί να φέρουν χρεώσεις, οι συνδυασμένες χρεώσεις τους ενδέχεται να ακυρώσουν.
Στην ουσία, η απουσία κατηγορίας σε μια ένωση προέρχεται από μια ισορροπία μεταξύ των φορτίων των συστατικών ατόμων της. Αυτή η ισορροπία μπορεί να επιτευχθεί μέσω της ίσης κατανομής ηλεκτρονίων σε ομοιοπολικούς δεσμούς ή της εξουδετέρωσης των φορτίων σε ιοντικές ενώσεις.