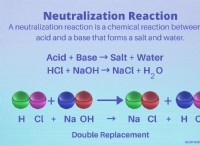
Πώς ξέρετε πότε έχετε εξίσωση ισορροπίας στη χημεία;
1. Ο αριθμός των ατόμων κάθε στοιχείου είναι ο ίδιος τόσο στο αντιδραστήριο όσο και στις πλευρές του προϊόντος της εξίσωσης.
Σκεφτείτε το σαν ένα χημικό σύστημα λογιστικής. Ξεκινάτε με έναν ορισμένο αριθμό ατόμων και πρέπει να καταλήξετε με τον ίδιο αριθμό κάθε τύπου ατόμου μετά την αντίδραση.
Παράδειγμα:
Μη ισορροπημένη: H₂ + o₂ → h₂o
* Αντιδραστήρια:2 άτομα υδρογόνου, 2 άτομα οξυγόνου
* Προϊόντα:2 άτομα υδρογόνου, 1 άτομο οξυγόνου
Ισορροπημένη: 2 h₂ + o₂ → 2 h₂o
* Αντιδραστήρια:4 άτομα υδρογόνου, 2 άτομα οξυγόνου
* Προϊόντα:4 άτομα υδρογόνου, 2 άτομα οξυγόνου
2. Η συνολική χρέωση και στις δύο πλευρές της εξίσωσης είναι ίση.
Αυτό είναι ιδιαίτερα σημαντικό για τις ιοντικές αντιδράσεις. Πρέπει να βεβαιωθείτε ότι οι συνολικές θετικές και αρνητικές χρεώσεις είναι οι ίδιες και στις δύο πλευρές.
Παράδειγμα:
Μη ισορροπημένη: Fe + Cu²⁺ → Fe2⁺ + Cu
* Αντιδραστήρια:0 Φόρτιση στο σίδηρο (Fe), +2 Φορτρωση σε ιόν χαλκού (Cu²⁺)
* Προϊόντα:+2 Φόρτιση στο Ion Iron (Fe2⁺), 0 Χάρη στον χαλκό (Cu)
Ισορροπημένη: Fe + Cu²⁺ → Fe2⁺ + Cu
* Αντιδραστήρια:0 Χρέωση ++2 Χρέωση =+2 Φόρτιση
* Προϊόντα:+2 Χρέωση +0 Χρέωση =+2 Χρέωση
Συμβουλές για την εξισορρόπηση των χημικών εξισώσεων:
* Ξεκινήστε με το πιο σύνθετο μόριο στην εξίσωση.
* Τα μέταλλα ισορροπίας πρώτα, στη συνέχεια τα μη μέταλλα, στη συνέχεια το υδρογόνο και το οξυγόνο τελευταία.
* Χρησιμοποιήστε συντελεστές (οι αριθμοί μπροστά από τους χημικούς τύπους) για να ρυθμίσετε τον αριθμό των ατόμων.
* Ποτέ μην αλλάζετε τους δείκτες μέσα σε μια χημική φόρμουλα.
Επιτρέψτε μου να ξέρω αν έχετε μια συγκεκριμένη χημική εξίσωση που θέλετε να ισορροπήσετε και μπορώ να σας βοηθήσω στη διαδικασία!