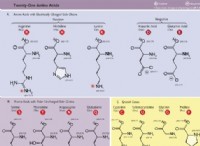
Γιατί διαλύονται οι διαλυμένες ουσίες;
1. Διαμοριακές δυνάμεις:
* αλληλεπιδράσεις διαλυτή διαλύτη: Ο σημαντικότερος παράγοντας είναι η ισχύς της έλξης μεταξύ των μορίων διαλυμένης ουσίας και διαλύτη. Εάν οι ελκυστικές δυνάμεις μεταξύ των μορίων διαλυμένης ουσίας και διαλύτη είναι ισχυρότερες από τις δυνάμεις μεταξύ των ίδιων των μορίων διαλυτής ουσίας και μεταξύ των ίδιων των μορίων διαλύτη, ευνοείται η διάλυση.
* Τύποι αλληλεπιδράσεων: Αυτά τα αξιοθέατα μπορούν να είναι:
* δεσμός υδρογόνου: Ισχυρή αλληλεπίδραση μεταξύ των μορίων που περιέχουν Η που συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (Ο, Ν, F).
* αλληλεπιδράσεις διπόλης-διπόλης: Έλξη μεταξύ πολικών μορίων.
* Δυνάμεις διασποράς του Λονδίνου: Αδύναμα αξιοθέατα που υπάρχουν σε όλα τα μόρια, ισχυρότερα σε μεγαλύτερα μόρια.
* αλληλεπιδράσεις ιόντων-διπόλης: Έλξη μεταξύ ιόντων και πολικών μορίων.
2. Εντροπία:
* Αυξημένη διαταραχή: Η διάλυση μιας διαλελυμένης ουσίας συχνά αυξάνει την εντροπία του συστήματος (διαταραχή). Αυτό οφείλεται στο γεγονός ότι τα μόρια διαλυμένης ουσίας γίνονται πιο διασκορπισμένα στη λύση. Η αύξηση της εντροπίας ευνοεί τη διαδικασία διάλυσης.
3. Ενθαλπία:
* Θερμότητα διαλύματος: Η διαδικασία διάλυσης μπορεί είτε να απελευθερώσει είτε να απορροφήσει θερμότητα.
* Εξαθερμική διάλυση: Εάν η διαδικασία απελευθερώσει θερμότητα (αρνητική αλλαγή ενθαλπίας), η διαδικασία ευνοείται σε χαμηλότερες θερμοκρασίες.
* ενδοθερμική διάλυση: Εάν η διαδικασία απορροφά τη θερμότητα (θετική αλλαγή ενθαλπίας), η διαδικασία ευνοείται σε υψηλότερες θερμοκρασίες.
4. Άλλοι παράγοντες:
* Πίεση: Η πίεση μπορεί να επηρεάσει τη διαλυτότητα των αερίων. Η αύξηση της πίεσης αυξάνει γενικά τη διαλυτότητα αερίου.
* Θερμοκρασία: Η θερμοκρασία μπορεί να επηρεάσει τη διαλυτότητα των στερεών, των υγρών και των αερίων. Γενικά, η διαλυτότητα των στερεών αυξάνεται με τη θερμοκρασία, ενώ η διαλυτότητα των αερίων μειώνεται με τη θερμοκρασία.
Συνοπτικά:
Οι διαλυμένες ουσίες διαλύονται όταν οι ελκυστικές δυνάμεις μεταξύ των μόρια διαλυμένης ουσίας και διαλύτη είναι αρκετά ισχυρές για να ξεπεράσουν τις δυνάμεις που συγκρατούν τα μόρια διαλυμένης ουσίας μαζί και τις δυνάμεις που συγκρατούν τα μόρια του διαλύτη μαζί. Αυτή η διαδικασία επηρεάζεται επίσης από τις αλλαγές στην εντροπία και την ενθαλπία.
Θυμηθείτε, η διαλυτότητα είναι ένα πολύπλοκο φαινόμενο που επηρεάζεται από διάφορους παράγοντες και μια λεπτομερής κατανόηση των διαμοριακών δυνάμεων και των θερμοδυναμικών αρχών είναι ζωτικής σημασίας για την πρόβλεψη και την εξήγηση της συμπεριφοράς διαλυτότητας.