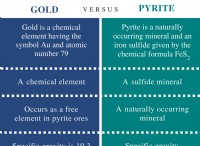
Ποιος είναι ο αριθμός των ηλεκτρονίων σε διάφορες περιοχές ένα άτομο;
Περιφέρειες ενός ατόμου:
* Επίπεδα ενέργειας (κέλυφος): Αυτά είναι σαν ομόκεντρους δακτυλίους γύρω από τον πυρήνα. Όσο υψηλότερο είναι το επίπεδο ενέργειας (1, 2, 3, κλπ.), Όσο πιο μακριά από τον πυρήνα είναι τα ηλεκτρόνια.
* Sublevels (Subshells): Κάθε επίπεδο ενέργειας χωρίζεται σε sublevels. Αυτά υποδηλώνονται με επιστολές:
* s: σφαιρικό σχήμα, διατηρεί μέχρι 2 ηλεκτρόνια
* p: Σχήμα αλτήρας, κρατά μέχρι 6 ηλεκτρόνια
* d: πιο σύνθετα σχήματα, διατηρεί μέχρι 10 ηλεκτρόνια
* f: Ακόμα πιο περίπλοκα σχήματα, διατηρεί μέχρι 14 ηλεκτρόνια
* Orbitals: Κάθε sublevel αποτελείται από ένα ή περισσότερα τροχιακά, τα οποία είναι συγκεκριμένες περιοχές του χώρου όπου ένα ηλεκτρόνιο είναι πιθανότερο να βρεθεί.
Προσδιορισμός διαμόρφωσης ηλεκτρονίων:
1. Ατομικός αριθμός: Ο ατομικός αριθμός σας λέει τον αριθμό των πρωτονίων σε ένα άτομο και σε ένα ουδέτερο άτομο, ισούται επίσης με τον αριθμό των ηλεκτρονίων.
2. Παραγγελία πλήρωσης: Τα ηλεκτρόνια γεμίζουν τα επίπεδα ενέργειας και τα sublevels με μια συγκεκριμένη σειρά:
* Αρχή Aufbau: Γεμίστε πρώτα τα χαμηλότερα επίπεδα ενέργειας.
* Κανόνας Hund: Τα ηλεκτρόνια γεμίζουν τροχιακά μέσα σε ένα sublevel ξεχωριστά πριν από τη σύζευξη.
* Αρχή αποκλεισμού Pauli: Κάθε τροχιά μπορεί να κρατήσει το μέγιστο δύο ηλεκτρόνια και πρέπει να έχουν αντίθετες περιστροφές.
3. Σημειώσεις διαμόρφωσης ηλεκτρονίων: Αυτός είναι ένας στενογραφικός τρόπος για τη σύνταξη της κατανομής των ηλεκτρονίων.
Παράδειγμα:
Ας πάρουμε το παράδειγμα του οξυγόνου (o) , που έχει ατομικό αριθμό 8.
1. Διαμόρφωση ηλεκτρονίων: 1S² 2S² 2P⁴
Επεξήγηση:
* 1S2: Το πρώτο επίπεδο ενέργειας (n =1) έχει ένα Sublevel, το «Sublevel», το οποίο μπορεί να κρατήσει 2 ηλεκτρόνια.
* 2S2: Το δεύτερο επίπεδο ενέργειας (n =2) έχει επίσης ένα 's' sublevel, το οποίο είναι γεμάτο με 2 ηλεκτρόνια.
* 2p⁴: Το δεύτερο επίπεδο ενέργειας διαθέτει επίσης ένα «P» P », το οποίο μπορεί να κρατήσει 6 ηλεκτρόνια. Το οξυγόνο διαθέτει 4 ηλεκτρόνια στο «p» του.
Επομένως:
* Επίπεδο ενέργειας 1: Έχει 2 ηλεκτρόνια (1S²)
* Επίπεδο ενέργειας 2: Έχει 6 ηλεκτρόνια (2S² 2P⁴)
Σημαντική σημείωση: Οι διαμορφώσεις ηλεκτρονίων μπορούν να γίνουν πιο πολύπλοκες για μεγαλύτερα άτομα, ειδικά με τα «D» και «F». Υπάρχουν χρήσιμοι πόροι όπως ο περιοδικός πίνακας και τα ηλεκτρονικά εργαλεία για να σας βοηθήσουν να καθορίσετε τις διαμορφώσεις ηλεκτρονίων για οποιοδήποτε άτομο.