Ορισμός Διπρωτικού Οξέος και Παραδείγματα
Ένα διπρωτικό Το οξύ είναι ένα οξύ που μπορεί να δώσει δύο ιόντα υδρογόνου (Η) ή πρωτόνια ανά μόριο σε ένα υδατικό διάλυμα. Ένα άλλο όνομα για ένα διπρωτικό οξύ είναι ένα διβασικό οξύ. Ένα διπρωτικό οξύ είναι ένας τύπος πολυπρωτικού οξέος, το οποίο είναι ένα οξύ ικανό να δώσει περισσότερα από ένα πρωτόνια ανά μόριο. Αντίθετα, ένα μονοπρωτικό οξύ δίνει μόνο ένα πρωτόνιο ή υδρογόνο στο νερό.
Παραδείγματα Διπρωτικού Οξέος
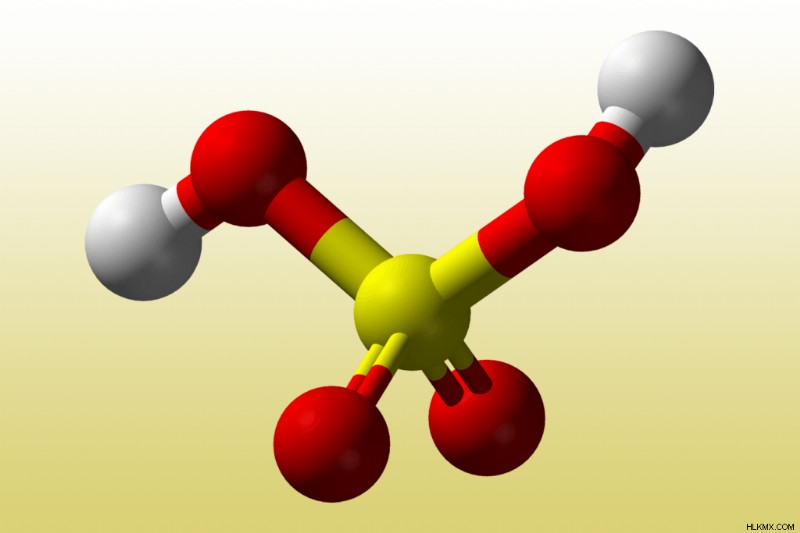
Παραδείγματα διπρωτικών οξέων περιλαμβάνουν το θειικό οξύ (H2 SO4 ), ανθρακικό οξύ (H2 CO3 ), χρωμικό οξύ (H2 CrO4 ), υδρόθειο (H2 S), και οξαλικό οξύ (H2 C2 O4 ).
Πώς λειτουργούν τα διπρωτικά οξέα
Οι μαθητές γενικά υποθέτουν ότι ένα διπρωτικό οξύ πάντα χάνει τόσο τα πρωτόνια του όσο και τα ιόντα υδρογόνου του. Ωστόσο, αυτό δεν συμβαίνει επειδή η ευκολία απώλειας του πρώτου και του δεύτερου πρωτονίου είναι συνήθως πολύ διαφορετική. Η πρώτη σταθερά διάστασης οξέος Ka είναι πάντα μεγαλύτερο από το δεύτερο. Με άλλα λόγια, είναι πάντα πιο εύκολο για ένα διπρωτικό οξύ να χάσει το πρώτο του πρωτόνιο παρά να χάσει το δεύτερο πρωτόνιό του.
Για παράδειγμα, το θειικό οξύ χάνει το πρώτο του πρωτόνιο τόσο εύκολα (Ka > 1) ότι δρα ως ισχυρό οξύ, σχηματίζοντας το όξινο θειικό ανιόν, HSO4 .
H2 SO4 (aq ) + H2 O(l ) → H3 O(aq ) + HSO4 (aq ) [Ka1 =1 x 10]
Το Ka επειδή η απώλεια του δεύτερου πρωτονίου είναι πολύ χαμηλότερη, επομένως μόνο το 10% περίπου των μορίων θειικού οξέος σε ένα διάλυμα 1Μ σχηματίζει το θειικό ανιόν (SO4 ).
HSO4 (aq ) + H2 O(l ) ↔ H3 O(aq ) + SO4 (aq ) [Ka2 =1,2 x 10]
Στην πράξη, το θειικό οξύ αποπρωτονιώνεται πλήρως ή χάνει και τα δύο άτομα υδρογόνου όταν αντιδρά με μια βάση, όπως η αμμωνία.
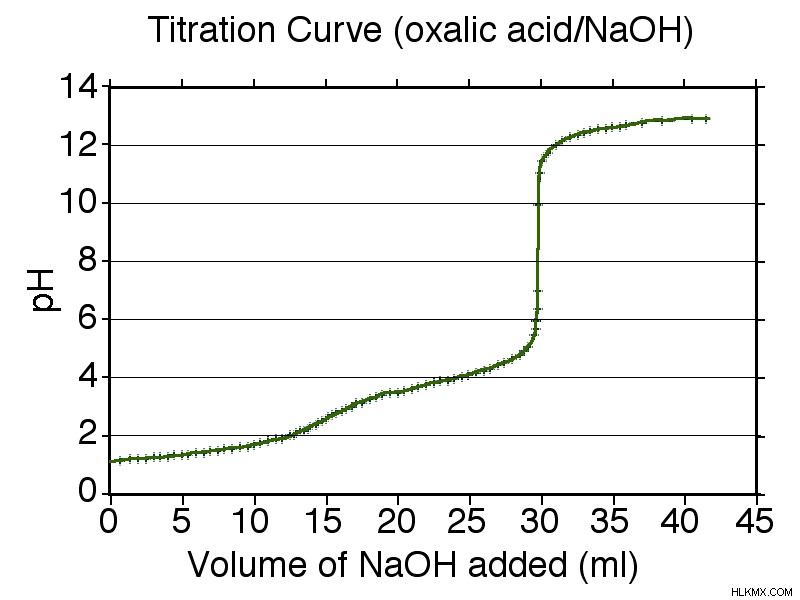
Καμπύλες τιτλοδότησης διπρωτικού οξέος
Η τιτλοδότηση χρησιμοποιείται για τον υπολογισμό των σταθερών διάστασης οξέος. Για ένα μονοπρωτικό οξύ, το pH του σημείου μιας καμπύλης τιτλοδότησης στα μισά της διαδρομής μεταξύ της έναρξης της καμπύλης και του σημείου ισοδυναμίας χρησιμοποιείται για να βρεθεί η τιμή pKa χρησιμοποιώντας την εξίσωση Henderson-Hasselbalch:
pH =pKa + log ([βάση]/[οξύ]
pH =pKa + log(1)
pH =pKa
Για ένα διπρωτικό οξύ, μπορείτε να βρείτε την πρώτη σταθερά διάστασης οξέος με τον ίδιο τρόπο όπως για ένα μονοπρωτικό οξύ. Η δεύτερη σταθερά διάστασης οξέος είναι το μισό σημείο μεταξύ του πρώτου σημείου ισοδυναμίας και του δεύτερου σημείου ισοδυναμίας.
Αναφορές
- Ebbing, Darrell; Gammon, Steven D. (1 Ιανουαρίου 2016). Γενική Χημεία . Cengage Learning. ISBN 9781305887299.
- Jameson, Reginald F. (1978). «Ορισμός των σταθερών συσχέτισης πρωτονίων για 3-(3,4-διυδροξυφαινυλ)αλανίνη (L-dopa)». Journal of the Chemical Society . Συναλλαγές Dalton. 0 (1):43–45. doi:10.1039/DT9780000043
- Petrucci R.H., Harwood, R.S.; Ρέγγα, F.G. (2002). Γενική Χημεία (8η έκδ.). Prentice-Hall. ISBN 0-13-014329-4.
- Skoog, D.A; West, D.M.; Holler, J.F.; Crouch, S.R. (2004). Βασικές αρχές της αναλυτικής χημείας (8η έκδ.). Τόμσον Μπρουκς/Κόουλ. ISBN 0-03-035523-0.