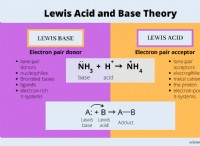
Πώς μπορεί η θερμότητα και το κρύο να επηρεάσουν μια χημική αντίδραση;
Θερμότητα:
* Αυξημένη κινητική ενέργεια: Η θερμότητα παρέχει ενέργεια στα μόρια, προκαλώντας τους να κινούνται ταχύτερα και να συγκρουστούν πιο συχνά. Αυτή η αυξημένη κινητική ενέργεια καθιστά πιο πιθανό ότι τα μόρια θα έχουν αρκετή ενέργεια για να ξεπεράσουν το εμπόδιο ενέργειας ενεργοποίησης, την ελάχιστη ενέργεια που απαιτείται για να συμβεί μια αντίδραση.
* Ανώτατο ποσοστό σύγκρουσης: Οι συχνότερες συγκρούσεις μεταξύ των μορίων αντιδραστηρίων αυξάνουν την πιθανότητα επιτυχημένων συγκρούσεων, οδηγώντας σε περισσότερο σχηματισμό προϊόντων.
* αυξημένος ρυθμός αντίδρασης: Ως αποτέλεσμα των αυξημένων ποσοστών σύγκρουσης και της υψηλότερης κινητικής ενέργειας, ο συνολικός ρυθμός χημικής αντίδρασης αυξάνεται με τη θερμότητα.
κρύο:
* Μειωμένη κινητική ενέργεια: Οι ψυχρές θερμοκρασίες μειώνουν την κινητική ενέργεια των μορίων, προκαλώντας τους να κινούνται πιο αργά και να συγκρουστούν λιγότερο συχνά.
* χαμηλότερος ρυθμός σύγκρουσης: Τα βραδύτερα μόρια έχουν χαμηλότερες πιθανότητες επιτυχημένων συγκρούσεων, οδηγώντας σε μείωση του σχηματισμού προϊόντων.
* μειωμένος ρυθμός αντίδρασης: Λόγω των μειωμένων ποσοστών σύγκρουσης και της χαμηλότερης κινητικής ενέργειας, ο συνολικός ρυθμός χημικής αντίδρασης μειώνεται με τις ψυχρές θερμοκρασίες.
Εξαιρέσεις:
* ενδοθερμικές αντιδράσεις: Ενώ η θερμότητα επιταχύνει γενικά τις αντιδράσεις, οι ενδοθερμικές αντιδράσεις απαιτούν εισροή ενέργειας για να προχωρήσουν. Σε τέτοιες περιπτώσεις, η αύξηση της θερμοκρασίας μπορεί στην πραγματικότητα να επιβραδύνει την αντίδραση, καθώς η είσοδος ενέργειας είναι μικρότερη από την ενέργεια που απαιτείται για την προβολή της αντίδρασης.
* Αντιδράσεις ισορροπίας: Σε αναστρέψιμες αντιδράσεις, η αύξηση της θερμοκρασίας μπορεί να μετατοπίσει την ισορροπία προς τα προϊόντα στις ενδοθερμικές αντιδράσεις και προς τα αντιδραστήρια σε εξαίθερες αντιδράσεις. Αυτό οφείλεται στην αρχή του Le Chatelier, η οποία δηλώνει ότι ένα σύστημα σε ισορροπία θα μετατοπιστεί για να ανακουφίσει το άγχος.
Άλλες εκτιμήσεις:
* Επίδραση καταλύτη: Οι καταλύτες επιταχύνουν τις αντιδράσεις χωρίς να καταναλώνονται. Λειτουργούν μειώνοντας την ενέργεια ενεργοποίησης, οπότε ακόμη και σε χαμηλές θερμοκρασίες, οι καταλύτες μπορούν να αυξήσουν σημαντικά τους ρυθμούς αντίδρασης.
* Αλλαγές φάσης: Η κατάσταση της ύλης (στερεό, υγρό ή αέριο) μπορεί να επηρεάσει τους ρυθμούς αντίδρασης. Οι αντιδράσεις εμφανίζονται ταχύτερα στην αέρια φάση, επειδή τα μόρια είναι πιο κινητά και συγκρούονται συχνότερα.
Συνοπτικά:
Η θερμότητα αυξάνει γενικά τον ρυθμό των χημικών αντιδράσεων αυξάνοντας την κινητική ενέργεια και τα ποσοστά σύγκρουσης. Το κρύο, από την άλλη πλευρά, επιβραδύνει τις αντιδράσεις λόγω της μειωμένης κινητικής ενέργειας και λιγότερων συγκρούσεων. Οι ενδοθερμικές αντιδράσεις και οι αντιδράσεις ισορροπίας αποτελούν εξαιρέσεις σε αυτόν τον γενικό κανόνα.