Θεωρία οξέος και βάσεων Lewis
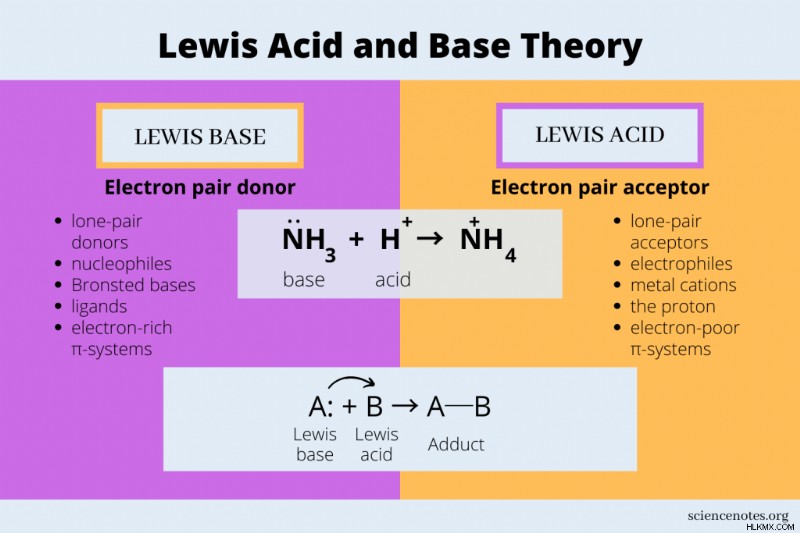
Η θεωρία οξέος και βάσης Lewis βλέπει το ηλεκτρόνιο ως το ενεργό είδος σε μια αντίδραση οξέος-βάσης. Ένα οξύ Lewis είναι ένας δέκτης ζεύγους ηλεκτρονίων, ενώ μια βάση Lewis είναι δότης ζεύγους ηλεκτρονίων. Αυτό έρχεται σε αντίθεση με τα οξέα και τις βάσεις Arrhenius και Bronsted-Lowry, τα οποία βλέπουν την αντίδραση από τη συμπεριφορά του ιόντος υδρογόνου ή του πρωτονίου, αντίστοιχα. Τα πλεονεκτήματα της θεωρίας Lewis είναι ότι διευρύνει τη λίστα οξέων και βάσεων και λειτουργεί καλά με αντιδράσεις οξείδωσης-αναγωγής.
- Ένα οξύ Lewis δέχεται ένα ζεύγος ηλεκτρονίων για να σχηματίσει έναν ομοιοπολικό δεσμό.
- Μια βάση Lewis δωρίζει ένα ζεύγος ηλεκτρονίων για να σχηματίσει έναν ομοιοπολικό δεσμό.
Ιστορικό
Ο Αμερικανός φυσικοχημικός Gilbert N. Lewis εφάρμοσε την κατανόησή του για τους χημικούς δεσμούς στη θεωρία του οξέος-βάσης. Το 1916, ο Lewis πρότεινε ότι ένας ομοιοπολικός δεσμός σχηματίζεται όταν κάθε άτομο συνεισφέρει ένα ηλεκτρόνιο για να σχηματίσει ένα ζεύγος ηλεκτρονίων που μοιράζονται τα άτομα. Όταν και τα δύο ηλεκτρόνια προέρχονται από ένα άτομο, ο χημικός δεσμός είναι ένας συντεταγμένος ή δοτικός ομοιοπολικός δεσμός. Το 1923, ο Lewis περιέγραψε ένα οξύ ως μια ουσία που «μπορεί να χρησιμοποιήσει ένα μοναχικό ζεύγος ηλεκτρονίων από ένα άλλο μόριο για να συμπληρώσει τη σταθερή ομάδα ενός από τα δικά του άτομα». Το 1963, η θεωρία επεκτάθηκε για να ταξινομήσει τα σκληρά και μαλακά οξέα και βάσεις (θεωρία HSAB).
Πώς λειτουργούν τα οξέα και οι βάσεις Lewis
Μια αντίδραση οξέος-βάσης Lewis περιλαμβάνει τη μεταφορά ενός ζεύγους ηλεκτρονίων από μια βάση σε ένα οξύ. Για παράδειγμα, το άτομο αζώτου στην αμμωνία (NH3 ) έχει ένα ζεύγος ηλεκτρονίων. Όταν η αμμωνία αντιδρά με το ιόν υδρογόνου (Η), το ζεύγος ηλεκτρονίων μεταφέρεται στο υδρογόνο, σχηματίζοντας το ιόν αμμωνίου (NH4 ).
NH3 + H → NH4
Έτσι, η αμμωνία είναι μια βάση Lewis και το κατιόν υδρογόνου είναι ένα οξύ Lewis. Τόσο η θεωρία Arrhenius όσο και η θεωρία Bronsted-Lowry περιγράφουν αυτήν την οξεοβασική αντίδραση.
Ωστόσο, η θεωρία οξέος και βάσης Lewis επιτρέπει επίσης οξέα που δεν περιέχουν υδρογόνο. Για παράδειγμα, τριφθοριούχο βόριο (BF3 ) είναι ένα οξύ Lewis όταν αντιδρά με την αμμωνία (η οποία είναι και πάλι μια βάση Lewis):
NH3 + BF3 → NH3 BF3
Το άζωτο δίνει το ζεύγος ηλεκτρονίων στο άτομο του βορίου. Τα δύο μόρια συνδυάζονται άμεσα και σχηματίζουν μια προσαγωγή . Ο δεσμός που σχηματίζεται μεταξύ των δύο ειδών είναι ένας δεσμός συντεταγμένων ή δοτικός ομοιοπολικός δεσμός .
Παραδείγματα οξέων και βάσεων Lewis
Οι βάσεις Lewis περιλαμβάνουν τις συνήθεις βάσεις κάτω από άλλους ορισμούς. Παραδείγματα βάσεων Lewis περιλαμβάνουν OH, NH3 , CN και H2 Τα οξέα O. Lewis περιλαμβάνουν τα συνήθη οξέα, συν τα είδη που δεν θεωρούνται οξέα υπό άλλους ορισμούς. Παραδείγματα οξέων Lewis περιλαμβάνουν H, HCl, Cu, CO2 , SiBr4 , AlF3 , BF3 , H2 O.
| Οξέα Lewis | Βάσεις Lewis |
|---|---|
| αποδέκτες μοναχικού ζεύγους | μοναχικοί δωρητές |
| ηλεκτρόφιλα | πυρηνόφιλοι |
| κατιόντα μετάλλων (π.χ. Ag, Mg) | Βάσεις Bronsted-Lowry |
| το πρωτόνιο (H) | συνδέτες |
| π-συστήματα φτωχά σε ηλεκτρονικά | π-συστήματα πλούσια σε ηλεκτρονικά |
Σκληρά και μαλακά οξέα και βάσεις Lewis (Θεωρία HSAB)
Τα οξέα και οι βάσεις Lewis ταξινομούνται ανάλογα με τη σκληρότητα ή την απαλότητα. Το σκληρό συνεπάγεται μικρό και μη πολωτικό. Το Soft ισχύει για μεγαλύτερα, πολώσιμα άτομα.
- Παραδείγματα σκληρών οξέων είναι το Η, τα κατιόντα μετάλλων αλκαλίων, τα κατιόντα μετάλλων αλκαλικών γαιών, ο Zn, τα βοράνια.
- Παραδείγματα μαλακών οξέων είναι τα Ag, Pt, Ni(0), Mo(0).
- Τυπικές σκληρές βάσεις είναι η αμμωνία, οι αμίνες, το νερό, το φθόριο, το χλωρίδιο και τα καρβοξυλικά.
- Παραδείγματα μαλακών βάσεων είναι το μονοξείδιο του άνθρακα, το ιώδιο, οι θειοαιθέρες και οι οργανοφωσφίνες.
Η θεωρία HSAB βοηθά στην πρόβλεψη της ισχύος του σχηματισμού προσαγωγών ή των προϊόντων των αντιδράσεων μετάθεσης. Οι αλληλεπιδράσεις σκληρού-σκληρού ευνοούνται από την ενθαλπία. Οι αλληλεπιδράσεις soft-soft είναι ευνοϊκές για την εντροπία.
Αμφοτερικά είδη
Ορισμένα χημικά είδη είναι αμφοτερικά, που σημαίνει ότι μπορούν να δράσουν είτε ως οξύ Lewis είτε ως βάση Lewis, ανάλογα με την κατάσταση. Νερό (H2 O) είναι ένα εξαιρετικό παράδειγμα.
Το νερό δρα ως οξύ όταν αντιδρά με την αμμωνία:
H2 O + NH3 → NH4 + OH
Λειτουργεί ως βάση όταν αντιδρά με υδροχλωρικό οξύ:
H2 O + HCl → Cl + H3 O
Υδροξείδιο του αργιλίου [Al(OH)3 ] είναι ένα παράδειγμα μιας αμφοτερικής ένωσης σύμφωνα με τη θεωρία Lewis. Λειτουργεί ως βάση Lewis στην αντίδραση με το ιόν υδρογόνου:
Al(OH)3 + 3H → Al + 3H2 O
Δρα ως οξύ Lewis στην αντίδραση με το ιόν υδροξειδίου:
Al(OH)3 + OH → Al(OH)4
Lewis Acids and Bases vs Bronsted-Lowry Acids and Bases
Η θεωρία των οξέων και βάσεων Bronsted-Lowry δημοσιεύτηκε την ίδια χρονιά με τη θεωρία Lewis. Οι δύο θεωρίες προβλέπουν οξέα και βάσεις χρησιμοποιώντας διαφορετικά κριτήρια, αλλά κυρίως η λίστα οξέων και βάσεων είναι η ίδια.
Όλες οι βάσεις Bronsted-Lowry είναι βάσεις Lewis. Όλα τα οξέα Bronsted-Lowry είναι οξέα Lewis. Επίσης, η συζευγμένη βάση ενός οξέος Bronsted-Lowry είναι μια βάση Lewis. Ωστόσο, υπάρχουν μερικά οξέα Lewis που δεν είναι οξέα Bronsted-Lowry. Επίσης, ορισμένες βάσεις Lewis δεν πρωτονιώνονται εύκολα, ωστόσο αντιδρούν με οξέα Lewis. Για παράδειγμα, το μονοξείδιο του άνθρακα (CO) είναι μια βάση Lewis που είναι πολύ αδύναμη βάση Bronsted-Lowry. Το μονοξείδιο του άνθρακα σχηματίζει ένα ισχυρό προϊόν προσθήκης με το φθοριούχο βηρύλλιο (BF3 ).
Αναφορές
- Carey, Francis A. (2003). Οργανική Χημεία (5η έκδ.). Βοστώνη:McGraw-Hill. ISBN 0-07-242458-3.
- IUPAC (1997). «Λούις οξύ». Compendium of Chemical Terminology (2η έκδ.) (the “Gold Book”). Επιστημονικές Εκδόσεις Blackwell. doi:10.1351/goldbook.L03508
- Jensen, W.B. (1980). The Lewis Acid-Base Concepts:An Overview . Νέα Υόρκη:Wiley. ISBN 0-471-03902-0.
- Lepetit, Christine; Maraval, Valérie; Canac, Yves; Chauvin, Remi (2016). «Σχετικά με τη φύση του δοτικού δεσμού:Συντονισμός στα μέταλλα και πέρα από αυτό. Η υπόθεση άνθρακα». Συντονιστικές Κριτικές Χημείας . 308:59–75. doi:10.1016/j.ccr.2015.07.018
- Lewis, Gilbert Newton (1923). Σθένος και η δομή των ατόμων και των μορίων . Αμερικανική Χημική Εταιρεία. Σειρά μονογραφίας. Νέα Υόρκη, Νέα Υόρκη, Η.Π.Α.:Chemical Catalog Company. ISBN 9780598985408.




