Η διαδικασία Haber-Bosch:Τι είναι και γιατί είναι τόσο σημαντική η διαδικασία;
Η διαδικασία Haber-Bosch συνδυάζει το ατμοσφαιρικό άζωτο με το υδρογόνο για την παραγωγή αμμωνίας, η οποία είναι ένα κύριο συστατικό των λιπασμάτων που χρησιμοποιούνται για την προώθηση της ανάπτυξης των φυτών.
Η διαδικασία Haber-Bosch, που επινοήθηκε το 1909-1910, είναι μια από τις σημαντικότερες εφευρέσεις που έγιναν στον τομέα της επιστήμης. Η διαδικασία πήρε το όνομά της από τους Γερμανούς χημικούς και εφευρέτες, Fritz Haber &Carl Bosch. Η διαδικασία συνδυάζει το ατμοσφαιρικό άζωτο με το υδρογόνο για να δημιουργήσει αμμωνία. Ακούγεται απλό, σωστά; Λοιπόν… δεν είναι.
Στην πραγματικότητα, η εφεύρεση της διαδικασίας είναι τόσο σημαντική που οι Haber και Bosch βραβεύτηκαν με βραβεία Νόμπελ για το έργο τους. Τώρα, μπορεί να αναρωτιέστε γιατί η παραγωγή αμμωνίας θεωρήθηκε ένα τόσο εξαιρετικό επίτευγμα που αξίζει το βραβείο Νόμπελ. Λοιπόν, προτού καταλάβουμε γιατί είναι τόσο σημαντικό, ας δούμε την ίδια τη διαδικασία.
Περισσότεροι από 400 εκατομμύρια τόνοι λιπασμάτων με βάση το άζωτο παράγονται κάθε χρόνο χρησιμοποιώντας τη διαδικασία Haber-Bosch. (Φωτογραφία:NoPainNoGain/ Shutterstock)
Τι είναι η διαδικασία Haber-Bosch;
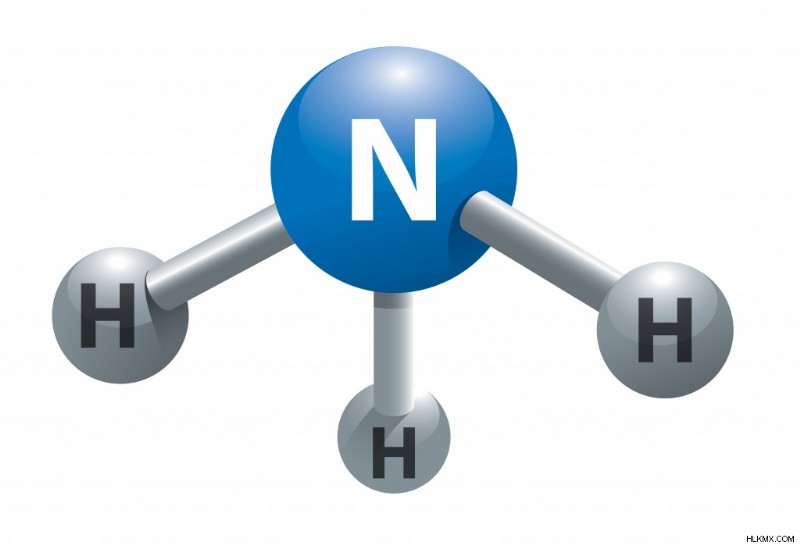
Η διαδικασία Haber-Bosch μετατρέπει το ατμοσφαιρικό άζωτο (N2) σε αμμωνία (NH3) συνδυάζοντάς το με υδρογόνο (H2). Η διαδικασία συνδυάζει ένα μόνο μόριο αζώτου με 3 μόρια υδρογόνου για να παράγει 2 μόρια αμμωνίας. Η χημική εξίσωση για τη διαδικασία Haber-Bosch είναι
N2 + 3H2 ⇌ 2NH3
Το βέλος ⇌ στην παραπάνω εξίσωση υποδηλώνει ότι η αντίδραση είναι αναστρέψιμη στη φύση της. Η αντίδραση τυχαίνει επίσης να είναι εξώθερμη.
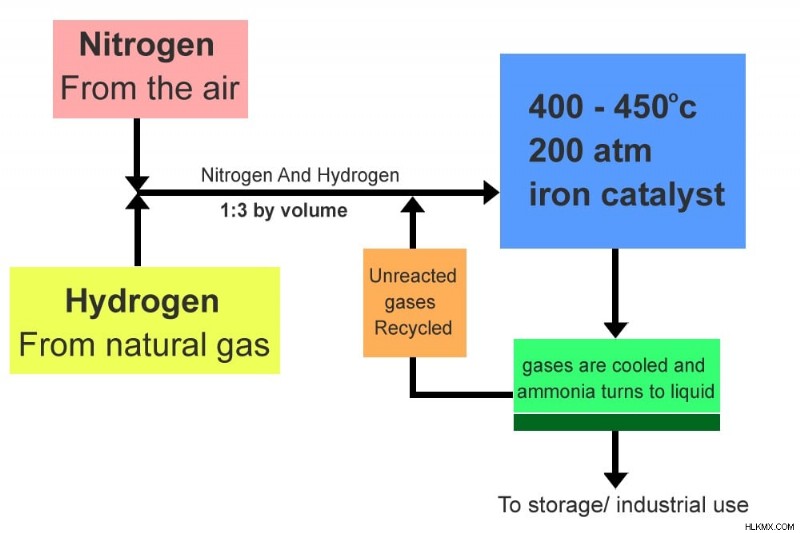
Διάγραμμα ροής της διαδικασίας Haber-Bosch.
Η κύρια πηγή υδρογόνου είναι το μεθάνιο (φυσικό αέριο). Στην πραγματικότητα, περίπου το 3% έως 5% της συνολικής παγκόσμιας παραγωγής φυσικού αερίου χρησιμοποιείται στη διαδικασία Haber-Bosch, ενώ το άζωτο εξάγεται απευθείας από την ατμόσφαιρα. Η αντίδραση λαμβάνει χώρα παρουσία καταλύτη σιδήρου, καθώς και σε υψηλές θερμοκρασίες και πιέσεις.
Σε κάθε πέρασμα από τη συσκευή αντίδρασης, μόνο το 15% περίπου των δύο αντιδρώντων μετατρέπεται σε άζωτο. Τα αέρια που δεν αντέδρασαν/μη συνδυασμένα ανακυκλώνονται και περνούν ξανά μέσα από τη συσκευή. Τα παραγόμενα μόρια αμμωνίας διέρχονται μέσω ενός συμπυκνωτή για συμπύκνωση και η υγρή αμμωνία εξάγεται για αποθήκευση και βιομηχανική χρήση.
Ο ρόλος του καταλύτη &της υψηλής πίεσης
Το άζωτο, στην ατμόσφαιρα, υπάρχει με τη μορφή διατομικών μορίων. Τα μόρια συνδέονται μεταξύ τους μέσω τριπλών ομοιοπολικών δεσμών. Αυτοί οι δεσμοί είναι πολύ ισχυροί και δύσκολο να σπάσουν. Ο καταλύτης βοηθά στη διάσπαση αυτών των δεσμών μεταξύ των μορίων του αζώτου και επίσης απορροφά άζωτο και υδρογόνο στην επιφάνειά του.
Η αρχική διεργασία Haber-Bosch χρησιμοποιούσε όσμιο ως καταλύτη. Ωστόσο, το όσμιο δεν είναι άμεσα διαθέσιμο. Οι περισσότερες σύγχρονες εκδόσεις της διαδικασίας Haber-Bosch χρησιμοποιούν καταλύτη σιδήρου αντ' αυτού. Ο σίδηρος με προαγωγείς όπως το KOH, το K2O, το Mo και το Al2O3 παρέχουν ένα τέλεια πορώδες και υψηλής επιφάνειας υλικό για την αντίδραση.
Οι υψηλές θερμοκρασίες και πιέσεις που περικλείουν τη χημική αντίδραση βοηθούν στην παράκαμψη της χημικής ισορροπίας και εμποδίζουν την εξέλιξη της αντίδρασης προς την αντίστροφη κατεύθυνση. Μια αντίδραση λέγεται ότι βρίσκεται σε χημική ισορροπία όταν ο αριθμός των αντιδρώντων και των προϊόντων δεν αλλάζει με το χρόνο.
Στην αρχή της αντίδρασης, η ποσότητα αζώτου και υδρογόνου είναι μεγαλύτερη, οπότε η αντίδραση παράγει αμμωνία με μεγάλη ταχύτητα. Καθώς η συγκέντρωση των δύο αντιδρώντων μειώνεται, ο ρυθμός μετατροπής πέφτει. Σύντομα επιτυγχάνεται ένα σημείο όταν η ποσότητα της αμμωνίας που παράγεται και η ταχύτητα με την οποία αποσυντίθεται η αμμωνία γίνονται ίσες. Αυτή η κατάσταση ονομάζεται χημική ισορροπία.
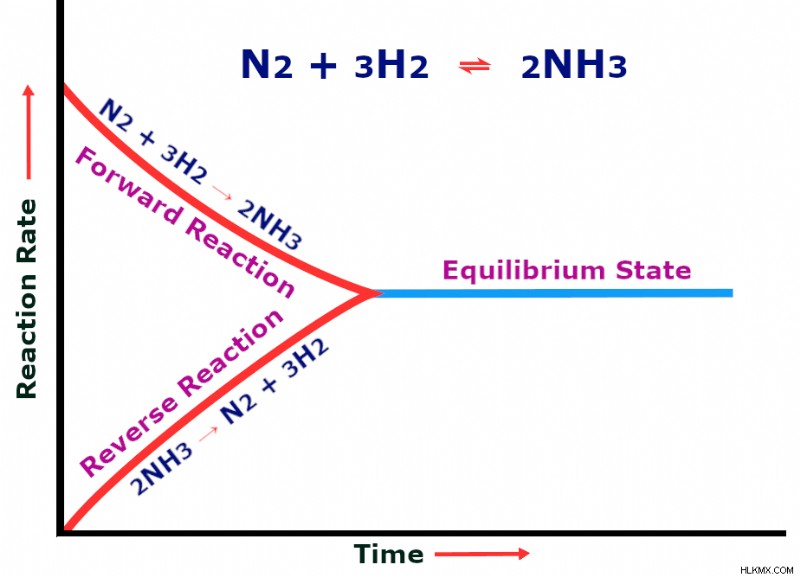
Όταν ο ρυθμός της μπροστινής αντίδρασης (N2 + 3H2 → 2NH3) γίνει ίσος με τον ρυθμό της αντίστροφης αντίδρασης (2NH3 → N2 + 3H2), λέγεται ότι επιτυγχάνεται μια κατάσταση ισορροπίας.
Σε αυτό το σημείο, δεν παράγεται πλέον αμμωνία. Για να συνεχιστεί η παραγωγή αμμωνίας και να διαταραχθεί η ισορροπία, η πίεση αυξάνεται. Σύμφωνα με την αρχή του Le Chatelier, «Αν αυξήσετε την πίεση ενός συστήματος, θα ανταποκριθεί ευνοώντας την αντίδραση που παράγει λιγότερους αριθμούς μορίων και συμβάλλει στη μείωση της πίεσης»
Στη διαδικασία Haber-Bosch, ο συνδυασμός αζώτου και υδρογόνου έχει ως αποτέλεσμα την παραγωγή λιγότερων συνολικών μορίων. Έτσι, η αντίδραση ξαναρχίζει προς τα εμπρός και η παραγωγή αμμωνίας συνεχίζεται.
Γιατί είναι τόσο σημαντική η διαδικασία Haber -Bosch;
Η διαδικασία Haber-Bosch είναι κρίσιμη για δύο λόγους:Πρώτον, η διαδικασία μας επιτρέπει να χρησιμοποιήσουμε την εκτεταμένη ποσότητα αζώτου που διατίθεται στην ατμόσφαιρα. Δεύτερον, το τελικό προϊόν της διαδικασίας τροφοδότησε και εξακολουθεί να βοηθά στη διατροφή περισσότερο από το ήμισυ του παγκόσμιου πληθυσμού. Θα εξηγήσω ότι αφού ρίξουμε μια ματιά στο πώς τα φυτά προετοιμάζουν την τροφή και γιατί το άζωτο είναι απαραίτητο για αυτή τη διαδικασία.
Γιατί τα φυτά χρειάζονται άζωτο;
Τα φυτά προετοιμάζουν την τροφή μέσω μιας διαδικασίας που ονομάζεται φωτοσύνθεση. Η χλωροφύλλη, η χρωστική ουσία που είναι υπεύθυνη για το πράσινο χρώμα των φυτών, τα βοηθά να απορροφούν ενέργεια από το ηλιακό φως και να πραγματοποιούν την αντίδραση φωτοσύνθεσης. Ένα από τα ζωτικά συστατικά της ένωσης της χλωροφύλλης είναι το άζωτο. Έτσι, η έλλειψη αζώτου σημαίνει ότι δεν υπάρχουν φωτοσυνθετικές αντιδράσεις. Παρόλο που το άζωτο είναι ένα από τα πιο άφθονα στοιχεία στη Γη, η έλλειψη αζώτου είναι σύνηθες φαινόμενο στα φυτά.
Οι ισχυροί ομοιοπολικοί δεσμοί μεταξύ του ατμοσφαιρικού αζώτου N2 καθιστούν τα μόρια αδρανή και μη χρήσιμα για τα φυτά. Δεδομένου ότι τα φυτά δεν μπορούν να χρησιμοποιήσουν το ατμοσφαιρικό άζωτο, αναζητούν άζωτο στο έδαφος από κάτω. Τα βακτήρια και τα αρχαία που υπάρχουν στο έδαφος μετατρέπουν τα μόρια N2 σε αμμωνία (NH3) και διάφορα οξείδια του αζώτου. Η διάσπαση του ατμοσφαιρικού αζώτου και η μετατροπή του σε μορφή που είναι χρήσιμη για τα φυτά ονομάζεται Αζωτοδέσμευση. Για περισσότερες πληροφορίες σχετικά με τη δέσμευση αζώτου, διαβάστε:Τι είναι ο κύκλος του αζώτου;.
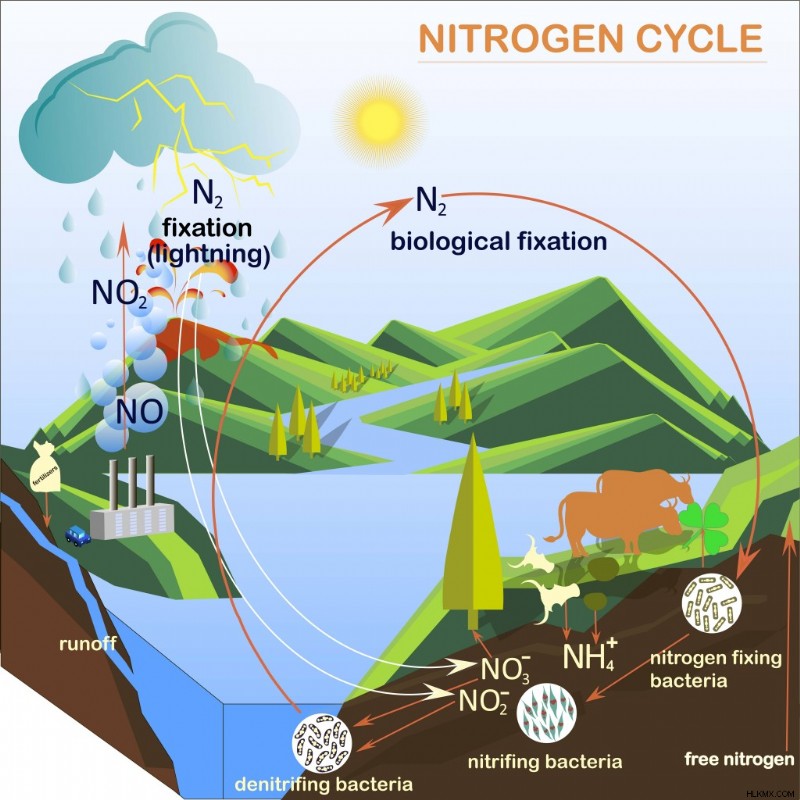
Η φυσική μετατροπή των μορίων του αζώτου σε χρησιμοποιήσιμο άζωτο (αμμωνία ή οξείδια του αζώτου) ονομάζεται κύκλος του αζώτου. (Φωτογραφία :danylyukk1/ Shutterstock)
Η ποσότητα αζώτου που σταθεροποιείται φυσικά είναι πολύ χαμηλή και η διαδικασία είναι πολύ αργή. Ως εκ τούτου, οι αγρότες στη δεκαετία του 1900 έπρεπε να χρησιμοποιήσουν γεωργικές τεχνικές όπως η αμειψισπορά ή η κοπριά αγελάδας ως λίπασμα για να μπορέσουν να καλλιεργήσουν φυτά με αξιοπρεπή ρυθμό.
Ο αντίκτυπος της διαδικασίας Haber-Bosch στην παραγωγή τροφίμων
Η ανάπτυξη της διαδικασίας Haber-Bosch μας βοήθησε να μετατρέψουμε το άζωτο σε μορφές που είναι πολύ πιο χρήσιμες για την ανθρωπότητα σε μεγαλύτερες ποσότητες και με μεγαλύτερη ταχύτητα. Έτσι, συνθετικά λιπάσματα που περιέχουν αμμωνία θα μπορούσαν εύκολα να παραχθούν και να χρησιμοποιηθούν για την τόνωση της ανάπτυξης των φυτών.
Η ανάπτυξη και η χρήση συνθετικών λιπασμάτων έπαιξαν σημαντικό ρόλο στη διατήρηση της πληθυσμιακής αύξησης τον τελευταίο αιώνα. Ο παγκόσμιος πληθυσμός, στην πραγματικότητα, έχει τετραπλασιαστεί από την ανακάλυψη αυτής της διαδικασίας. Ο παγκόσμιος πληθυσμός στις αρχές του 1900 ήταν περίπου 1,7 δισεκατομμύρια, ενώ ο σημερινός παγκόσμιος πληθυσμός ανέρχεται στα 7,7 δισεκατομμύρια. Χωρίς λιπάσματα, μόνο το ένα τρίτο περίπου των τροφίμων που παράγονται αυτήν τη στιγμή θα ήταν διαθέσιμο.
Συμπέρασμα
Λαμβάνοντας υπόψη τον αντίκτυπο των λιπασμάτων στην παραγωγή τροφίμων, δεν θα ήταν υπερβολή να πούμε ότι η διαδικασία Haber-Bosch έχει βοηθήσει να τροφοδοτηθεί περισσότερο από το ήμισυ του παγκόσμιου πληθυσμού. Επί του παρόντος, περίπου 400-450 εκατομμύρια τόνοι λιπασμάτων με βάση το άζωτο παράγονται κάθε χρόνο χρησιμοποιώντας τη διαδικασία Haber-Bosch.
Ωστόσο, τα λιπάσματα είναι μόνο ένα από τα προϊόντα που προέρχονται από την αμμωνία. Άλλες χρήσεις της αμμωνίας περιλαμβάνουν τη χρήση της ως ψυκτικό μέσο, στην παραγωγή εκρηκτικών, την παραγωγή νάιλον/πλαστικών και πολλά άλλα.
Εξακολουθείτε να είστε περίεργοι γιατί οι Haber και Bosch άξιζαν τα βραβεία Νόμπελ για την επινόηση της διαδικασίας; Δοκιμάστε να βάλετε φαγητό στα πιάτα του μισού παγκόσμιου πληθυσμού και ίσως κερδίσετε κι εσείς!




