Πόση ουσία είναι σε αραιωμένα διαλύματα;
* Η αραίωση είναι σχετική: Το αραιωμένο απλά σημαίνει ότι η συγκέντρωση της διαλελυμένης ουσίας είναι χαμηλότερη από ό, τι στην αρχική λύση. Δεν μας λέει το απόλυτο ποσό της διαλυμένης ουσίας που υπάρχει.
* Εξαρτάται από την λύση εκκίνησης: Πόση ουσία είναι σε ένα αραιωμένο διάλυμα εξαρτάται από την αρχική συγκέντρωση του αρχικού διαλύματος και από την ποσότητα του διαλύτη που προστίθεται για να τον αραιώσει.
Εδώ είναι ένας τρόπος να το σκεφτείτε:
Φανταστείτε ότι έχετε ένα ποτήρι χυμό πορτοκαλιού (η διαλυμένη ουσία είναι το συμπύκνωμα χυμού πορτοκαλιού και ο διαλύτης είναι νερό). Προσθέτετε περισσότερο νερό στο γυαλί (αραιώστε το). Η ποσότητα συμπυκνωμένου χυμού πορτοκαλιού (διαλυμένη ουσία) παραμένει η ίδια, αλλά ο συνολικός όγκος του διαλύματος αυξάνεται. Αυτό σημαίνει ότι η συγκέντρωση του συμπυκνωμένου χυμού πορτοκαλιού είναι πλέον χαμηλότερη.
Για να υπολογίσετε την ποσότητα διαλυμένης ουσίας σε ένα αραιωμένο διάλυμα, χρειάζεστε:
1. Η αρχική συγκέντρωση του διαλύματος. Αυτό συνήθως εκφράζεται σε μονάδες όπως η γραμμομοριακή (moles ανά λίτρο) ή το ποσοστό (μάζα/όγκος ή όγκος/όγκος).
2. Ο όγκος της αρχικής λύσης.
3. Ο τελικός όγκος του αραιωμένου διαλύματος.
Εδώ είναι μια φόρμουλα για τον υπολογισμό της ποσότητας διαλυμένης ουσίας σε ένα αραιωμένο διάλυμα:
`` `
Ποσότητα διαλυμένης ουσίας (στο αραιωμένο διάλυμα) =αρχική συγκέντρωση x αρχικός όγκος
`` `
Παράδειγμα:
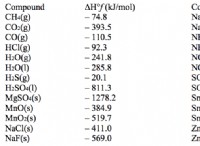
* Έχετε 100 ml διαλύματος 1 Μ NaCl (χλωριούχο νάτριο).
* Το αραιώνετε σε 500 ml.
* Η ποσότητα NaCl στο αραιωμένο διάλυμα είναι:1 m x 100 ml =100 mmol (χιλιοστά)
Επιτρέψτε μου να ξέρω αν έχετε κατά νου ένα συγκεκριμένο σενάριο αραίωσης και μπορώ να σας βοηθήσω να υπολογίσετε το ποσό της διαλυμένης ουσίας!