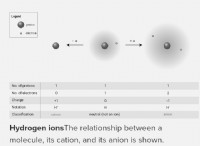
Τι είναι το αποτέλεσμα του διαλύτη της φύσης στη λύση ηλεκτρικής αγωγιμότητας;
Κατανόηση της ηλεκτρικής αγωγιμότητας
* Τα ιόντα είναι κλειδί: Η ηλεκτρική αγωγιμότητα σε ένα διάλυμα προκύπτει από την κίνηση φορτισμένων σωματιδίων (ιόντα).
* Λύση: Για να μετακινηθούν και να μεταφέρουν τα ιόντα, πρέπει να διαλυθούν σε έναν διαλύτη.
* Διάσπαση: Πολλές ουσίες, ειδικά ιοντικές ενώσεις (όπως άλατα), διασπούν σε ιόντα όταν διαλύονται σε κατάλληλο διαλύτη.
Ο ρόλος του διαλύτη
* Πολικοί διαλύτες: Οι διαλύτες με πολική δομή (όπως το νερό, η αιθανόλη ή η ακετόνη) είναι καλύτεροι στη διάλυση ιοντικών ενώσεων. Έχουν ένα θετικό και αρνητικό τέλος στα μόρια τους, τα οποία μπορούν να αλληλεπιδρούν με τα φορτισμένα ιόντα, να τα απομακρύνουν και να τα διατηρούν σε λύση.
* Μη πολικοί διαλύτες: Οι μη πολικοί διαλύτες (όπως εξάνιο, βενζόλιο) είναι φτωχοί στη διάλυση των ιοντικών ενώσεων. Τα μόρια τους έχουν ισορροπημένη κατανομή φορτίου, έτσι ώστε να μην αλληλεπιδρούν αποτελεσματικά με τα ιόντα.
Πώς ο διαλύτης επηρεάζει την αγωγιμότητα:
1. Δυνατότητα διάλυσης: Η ικανότητα ενός διαλύτη να διαλύσει μια ουσία είναι κρίσιμη. Εάν ο διαλύτης δεν διαλύσει την ουσία, δεν θα υπάρχουν ιόντα που υπάρχουν για να μεταφέρουν το ρεύμα.
2. Κινητικότητα ιόντων: Ακόμη και αν διαλυθεί μια ουσία, η αγωγιμότητα εξαρτάται από το πόσο ελεύθερα τα ιόντα μπορούν να κινηθούν.
* ιξώδες: Το υψηλότερο ιξώδες (πάχος) του διαλύτη περιορίζει την κίνηση ιόντων, μειώνοντας την αγωγιμότητα.
* αλληλεπιδράσεις διαλύτη ιόντων: Οι ισχυρές αλληλεπιδράσεις μεταξύ του διαλύτη και των ιόντων μπορούν να "παγιδεύσουν" ιόντα, περιορίζοντας την κίνηση και την αγωγιμότητά τους.
Παραδείγματα:
* νερό: Ένας εξαιρετικά πολικός διαλύτης, εξαιρετικός στη διάλυση ιοντικών ενώσεων, που οδηγούν σε υψηλή αγωγιμότητα.
* εξάνιο: Ένας μη πολικός διαλύτης, ανεπαρκώς διαλύοντας ιοντικές ενώσεις, με αποτέλεσμα τη χαμηλή αγωγιμότητα.
* γλυκερόλη: Ένας ιξώδης διαλύτης, ακόμη και αν διαλύει τα ιόντα, το υψηλό ιξώδες του μειώνει την αγωγιμότητα.
Βασικά σημεία
* Η φύση του διαλύτη επηρεάζει έντονα την ηλεκτρική αγωγιμότητα μιας λύσης.
* Οι πολικοί διαλύτες είναι γενικά καλύτεροι αγωγοί από τους μη πολικούς διαλύτες.
* Οι αλληλεπιδράσεις ιξώδους και ιόντων διαλύτη μπορούν επίσης να επηρεάσουν την αγωγιμότητα.
Επιτρέψτε μου να ξέρω αν θέλετε να εξερευνήσετε συγκεκριμένα παραδείγματα ή να έχετε περισσότερες ερωτήσεις!