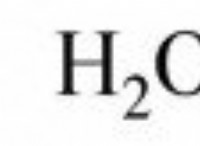Γιατί το βηρύλλιο μπορεί εύκολα να υδρολύσει;
1. Μικρό μέγεθος και υψηλή πυκνότητα φορτίου:
* Το Beryllium έχει μια μικρή ατομική ακτίνα και μια υψηλή πυκνότητα φορτίου (υψηλό θετικό φορτίο συμπυκνωμένο σε μικρό όγκο). Αυτό καθιστά το θετικό του φορτίο πολύ συγκεντρωμένο, προσελκύοντας ηλεκτρόνια από τα άτομα οξυγόνου σε μόρια νερού.
2. Αδύναμη ενυδάτωση:
* Ενώ το βηρύλλιο μπορεί να σχηματίσει δεσμούς με μόρια νερού (ενυδάτωση), αυτοί οι δεσμοί είναι σχετικά αδύναμοι. Αυτό οφείλεται στο γεγονός ότι το μικρό του μέγεθος καθιστά δύσκολη τη δυνατότητα να φιλοξενήσει τα σύννεφα ηλεκτρονίων των μορίων νερού γύρω από αυτό.
3. Σχηματισμός Be (OH) ₂:
* Η αντίδραση του βηρυλλίου με νερό έχει ως αποτέλεσμα τον σχηματισμό υδροξειδίου του βηρυλλίου, να είναι (ΟΗ) ₂. Αυτό το υδροξείδιο είναι αμφοτερικό, που σημαίνει ότι μπορεί να δράσει τόσο ως οξύ όσο και ως βάση.
4. Υδρόλυση του ΒΕ (ΟΗ) ₂:
* BE (OH) ₂ Περαιτέρω υδρολύσεις στο νερό, απελευθερώνοντας πρωτόνια (H⁺) και σχηματίζοντας ένα σύνθετο είδος:[Be (OH) ₄] ². Αυτή η διαδικασία καθιστά το διάλυμα όξινο.
Συνολικά, ο συνδυασμός αυτών των παραγόντων καθιστά το βηρύλλιο ιδιαίτερα ευαίσθητο στην υδρόλυση. Η ισχυρή έλξη μεταξύ των ατόμων βηρυλλίου και οξυγόνου, η αδύναμη ενυδάτωση και ο σχηματισμός προϊόντων όξινης υδρόλυσης συμβάλλουν σε αυτή την αντιδραστικότητα.
Συνέπειες της υδρόλυσης:
* Η υδρόλυση των ενώσεων βηρυλλίου οδηγεί στην απελευθέρωση ιόντων βηρυλλίου, τα οποία είναι ιδιαίτερα τοξικά.
* Αυτό κάνει το χειρισμό βηρυλλίας και τις ενώσεις του επικίνδυνες, απαιτώντας εξειδικευμένα πρωτόκολλα ασφαλείας.
Σημείωση: Ενώ η διαδικασία υδρόλυσης είναι πολύπλοκη, απλοποιείται εδώ για κατανόηση. Ο πραγματικός μηχανισμός περιλαμβάνει διάφορα ενδιάμεσα βήματα και αντιδράσεις ισορροπίας.