Το SO2 είναι πολικό ή μη πολικό;

Πιθανότατα έχετε ακούσει ότι τα μόρια έχουν κάτι που ονομάζεται πολικότητα. Για παράδειγμα, το νερό είναι ένα πολικό μόριο ενώ το διοξείδιο του άνθρακα είναι ένα μη πολικό μόριο. Τι γίνεται με το διοξείδιο του θείου, είναι πολικό ή μη; Το διοξείδιο του θείου θεωρείται πολικό μόριο.
Τι ακριβώς σημαίνει το να είσαι φτωχό μόριο; Επιπλέον, ποιες ιδιότητες έχει το διοξείδιο του θείου που το καθιστούν πολικό μόριο; Για να το ανακαλύψουμε, ας εξετάσουμε τον ορισμό της πολικότητας και ας ρίξουμε μια ματιά στις ιδιότητες που έχει ένα μόριο διοξειδίου του θείου.
Τι είναι η πολικότητα;
Όταν σκέφτεστε πόλους το πρώτο πράγμα που μπορεί να σκεφτείτε μπορεί να είναι ο νότιος και ο βόρειος πόλος της Γης. Αυτές είναι οι πάνω και κάτω περιοχές της γης. Όπως και η γη, τα μόρια μπορεί να έχουν πολικές περιοχές, αλλά αυτές οι πολικές περιοχές είναι θετικές και αρνητικές στη φύση τους. Είναι τα άκρα των μορίων που έχουν είτε αρνητικό είτε θετικό φορτίο, όπως μια μπαταρία έχει αρνητικό και θετικό άκρο.
Δεδομένου ότι τα μόρια αποτελούνται από άτομα, αυτά τα άτομα συνδέονται μεταξύ τους για να δημιουργήσουν τμήματα που έχουν ένα συνολικό θετικό φορτίο ή ένα συνολικό αρνητικό φορτίο. Εάν ένα άτομο έχει διακριτές περιοχές θετικού φορτίου και αρνητικού φορτίου - εάν υπάρχουν και αρνητικές και θετικές περιοχές μέσα στο μόριο - το μόριο είναι πολικό. Εάν το μόριο δεν έχει περιοχές που διαφέρουν ως προς το φορτίο, το μόριο θεωρείται μη πολικό.
Παραδείγματα πολικών και μη πολικών μορίων
Ως παράδειγμα πολικού μορίου, ας ρίξουμε μια ματιά στο νερό. Το νερό είναι ένα από τα πιο διάσημα πολικά μόρια και η δομή του είναι υπεύθυνη για να κάνει το μόριο να έχει πολική φύση. Τα μόρια του νερού αποτελούνται από ένα άτομο οξυγόνου που έχει ελαφρώς αρνητικό φορτίο και δύο άτομα υδρογόνου που έχουν ελαφρά θετικά φορτία. Αυτό σημαίνει ότι το νερό είναι ένα πολικό μόριο.
Ως παράδειγμα μη πολικού μορίου λάβετε υπόψη το αιθάνιο - το οποίο είναι ένας χημικός τύπος του C2H6. Ένας από τους λόγους που το αιθάνιο είναι μη πολικό μόριο είναι ότι το μόριο έχει συμμετρική δομή. Οι συμμετρικές δομές στα μόρια βοηθούν το μόριο να διατηρεί μια ομοιόμορφη κατανομή ηλεκτραρνητικότητας, αν και δεν εγγυάται απαραίτητα ότι ένα μόριο θα είναι μη πολικό. Ωστόσο, στην περίπτωση του αιθανίου, υπάρχει μικρή έως καθόλου διαφορά στις ποσότητες ηλεκτραρνητικότητας που υπάρχει μεταξύ των ατόμων άνθρακα και των ατόμων υδρογόνου και μικρή διαφορά στην ηλεκτραρνητικότητα που βρίσκεται μεταξύ των δύο ατόμων άνθρακα.
Τα περισσότερα αλκαλικά στοιχεία έχουν παρόμοια δομή με το C2H6 και για αυτό το λόγο, λέγεται χαρακτηριστικά ότι τα αλκαλικά στοιχεία είναι μη πολικά. Η χημεία έχει μια έννοια που συχνά συνοψίζεται ως "όπως διαλύει όπως". Αυτό σημαίνει ότι ένα μόριο έχει μεγαλύτερη διαλυτότητα όταν βρίσκεται μέσα σε μια παρόμοια ουσία. Οι πολικές ουσίες διαλύονται πιο εύκολα όταν συνδυάζονται με άλλα πολικά μόρια και οι μη πολικές ουσίες διαλύονται πιο εύκολα όταν συνδυάζονται με άλλες μη πολικές ουσίες.
Πώς οι περιοχές των μορίων γίνονται πολικές ή μη πολικές
Τα ηλεκτρόνια μέσα στα μόρια έλκονται συνεχώς γύρω. Αυτό σημαίνει ότι τα ηλεκτρόνια μέσα σε ένα μόριο μετατοπίζονται πάντα θέσεις και η πολικότητα ενός μορίου επηρεάζεται από τη μετατόπιση ενός συνόλου ηλεκτρονίων. Καθώς τα ηλεκτρόνια κινούνται προς τη μία ή την άλλη κατεύθυνση, το μόριο αποκτά θετικό ή αρνητικό φορτίο στην περιοχή αυτού του ηλεκτρονίου. Αυτό που επηρεάζει τον τρόπο με τον οποίο μετατοπίζονται τα ηλεκτρόνια είναι οι δεσμοί που υπάρχουν μεταξύ των μορίων. Αυτοί οι χημικοί δεσμοί περιέχουν επίσης ηλεκτρόνια και μπορούν επίσης να έχουν πολικότητα.
Εάν τα άτομα που συνθέτουν έναν χημικό δεσμό είναι διαφορετικά, τότε ο δεσμός μεταξύ των δύο ατόμων θα είναι πολικής φύσης. Αυτό συμβαίνει επειδή όταν δύο διαφορετικά άτομα δημιουργούν έναν δεσμό, οι πυρήνες των αντίστοιχων ατόμων θα έχουν διαφορετικές ικανότητες σύλληψης ηλεκτρονίων και οι θέσεις των ηλεκτρονίων εντός του δεσμού θα μετατοπιστούν. Ωστόσο, όταν υπάρχουν δύο άτομα του ίδιου τύπου που συνθέτουν έναν δεσμό, τα ηλεκτρόνια εντός του δεσμού θα μετατοπίσουν τη θέση τους επειδή η ποσότητα έλξης που έχει κάθε άτομο είναι ισοδύναμη και τα ηλεκτρόνια που διαθέτει κάθε άτομο θα παραμείνουν εκεί που βρίσκονται. /P>
Το άτομο που έχει τη μεγαλύτερη ικανότητα να έλκει ηλεκτρόνια προς το μέρος του θα έχει αυξημένο αριθμό ηλεκτρονίων γύρω του, θα έχει ένα ελαφρώς πιο αρνητικό φορτίο συνολικά και το τελικό αποτέλεσμα είναι μια περιοχή του δεσμού που είναι θετική και μέρος του δεσμού που είναι αρνητικό, καθιστώντας έτσι τον δεσμό πολικό στη φύση του. Μπορείτε επίσης να το φανταστείτε ως ηλεκτρόνια που αποτελούν μέρος ενός πολικού δεσμού που συγκλίνουν στο ένα άκρο του δεσμού ή στο άλλο και. Είτε έτσι είτε αλλιώς, θα υπάρχει ένα μέρος του δεσμού που έχει ελαφρώς πιο θετικό φορτίο και ένα μέρος του δεσμού που έχει ελαφρώς αρνητικό φορτίο.
Πώς η δομή ενός ατόμου επηρεάζει την πολικότητα του
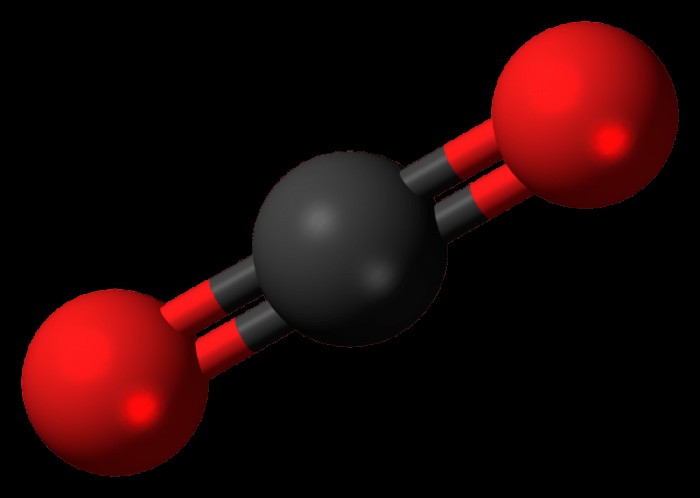
Αν και είναι δελεαστικό να συμπεράνουμε ότι όσο περισσότερα αρνητικά άτομα έχει ένα μόριο τόσο πιο πιθανό είναι να είναι πολικό, αυτό δεν συμβαίνει πάντα. Ως παράδειγμα ενός μορίου με περισσότερους αρνητικούς δεσμούς που είναι μη πολικό, δείτε το διοξείδιο του άνθρακα. Το διοξείδιο του άνθρακα έχει ένα μόριο άνθρακα και δύο μόρια οξυγόνου και οι δεσμοί που δημιουργούν το μόριο μπορούν να αναπαρασταθούν με αυτόν τον τρόπο:
O =C =O
Πρέπει να λάβει κανείς υπόψη όχι μόνο τον συνολικό αριθμό των δεσμών και τη θετική ή αρνητική φύση τους αλλά και τη δομή του μορίου. Στην περίπτωση του διοξειδίου του άνθρακα, το μόριο είναι συμμετρικής φύσης και έχει γραμμική δομή. Και τα δύο άτομα οξυγόνου ασκούν την ίδια έλξη στο άτομο άνθρακα στη μέση, δημιουργώντας μια κατάσταση όπου η έλξη ενός ατόμου οξυγόνου μηδενίζεται από το άλλο και τα ηλεκτρόνια μέσα στο άτομο δεν κινούνται καθόλου. Έτσι το μόριο διατηρεί την ισορροπία του ως μη πολικό μόριο.
Γιατί το SO2 είναι πολικό;

Το διοξείδιο του θείου απελευθερώνεται φυσικά από την ηφαιστειακή δραστηριότητα και υπάρχει επίσης στην ατμόσφαιρα λόγω της καύσης ορυκτών καυσίμων. Το διοξείδιο του θείου έχει μια πικάντικη μυρωδιά, που συχνά παρομοιάζεται με τη μυρωδιά ενός σπίρτου που μόλις άναψε. Όπως και στο παράδειγμα του διοξειδίου του άνθρακα, όχι μόνο πρέπει να λάβετε υπόψη τους τύπους ατόμων σε ένα μόριο διοξειδίου του θείου, αλλά πρέπει επίσης να λάβετε υπόψη τη δομή του μορίου.
Πρώτα απ 'όλα, είναι σημαντικό να γνωρίζουμε ότι οι δεσμοί οξυγόνου-θείου είναι ελαφρώς πολικοί, λόγω του γεγονότος ότι το οξυγόνο έχει μεγαλύτερο ηλεκτραρνητικό δυναμικό από το θείο. Αυτό σημαίνει ότι το οξυγόνο ασκεί μεγαλύτερη έλξη στους ομοιοπολικούς δεσμούς στο διοξείδιο του θείου. Ωστόσο, όπως συζητήθηκε προηγουμένως, η δομή του μορίου κάνει επίσης τη διαφορά.
Όπως το H2O, το θείο βρίσκεται στη μέση του μορίου, με λυγισμένους δεσμούς που συνδέουν το θείο με το οξυγόνο. Αυτό σημαίνει ότι υπάρχει μια πλευρά (πάνω ή κάτω) του μορίου που έχει και τα δύο άτομα οξυγόνου πάνω της, γεγονός που του δίνει ένα ελαφρώς αρνητικό φορτίο ενώ το τμήμα του μορίου που έχει το άτομο θείου έχει ελαφρώς θετικό φορτίο. Ως αποτέλεσμα αυτού, το SO2 είναι πολικό.
Έτσι, στην ουσία, το διοξείδιο του θείου είναι πολικό ενώ το διοξείδιο του άνθρακα είναι μη πολικό επειδή οι μεμονωμένες κινήσεις των δεσμών στο διοξείδιο του άνθρακα αλληλοεξουδετερώνονται, ωστόσο στην περίπτωση του διοξειδίου του θείου, η γωνιακή φύση του μορίου σημαίνει ότι υπάρχει μια ανισορροπία μεταξύ των πόλους – ότι έχει και αρνητική και θετική πλευρά – και επομένως το μόριο είναι πολικό.
Βασικά σημεία που πρέπει να ληφθούν υπόψη κατά τον προσδιορισμό της πολικότητας ενός μορίου
Όταν προσπαθείτε να προσδιορίσετε την πολικότητα ενός μορίου, μπορείτε να χρησιμοποιήσετε μια διαδικασία τριών βημάτων για να το αναλύσετε. Το πρώτο βήμα είναι η σχεδίαση της δομής Lewis του μορίου, ενώ το δεύτερο βήμα είναι ο προσδιορισμός της γεωμετρίας του μορίου και το τελικό βήμα είναι ο προσδιορισμός των πολικών δεσμών του μορίου και η άθροιση των πολικοτήτων των δεσμών μαζί.
Η σχεδίαση της δομής Lewis σημαίνει σχεδίαση μιας αναπαράστασης του μορίου μέσω ενός διαγράμματος που υποδεικνύει τον αριθμό των ηλεκτρονίων σθένους και των δεσμών του μορίου. Αφού γίνει αυτό, η γεωμετρία του μορίου μπορεί να προσδιοριστεί με τη Θεωρία Απώθησης ζεύγους ηλεκτρονίων κελύφους σθένους (VSEPR Theory), η οποία δηλώνει ότι τα μόρια θα υιοθετήσουν έναν γεωμετρικό σχηματισμό που μεγιστοποιεί την απόσταση που έχουν τα ηλεκτρόνια το ένα από το άλλο.
Τέλος, πρέπει να προσδιορίσετε την ισχύ των δεσμών και να αθροίσετε τις πολικότητες των δεσμών τους μαζί. Για παράδειγμα, στο διοξείδιο του άνθρακα, οι δεσμοί άνθρακα-οξυγόνου είναι πολωμένοι προς το οξυγόνο, το οποίο είναι πιο ηλεκτραρνητικό, και δεδομένου ότι και οι δύο δεσμοί έχουν το ίδιο μέγεθος, το άθροισμά τους είναι μηδέν και το μόριο ταξινομείται ως μη πολικό.
Στην περίπτωση του διοξειδίου του θείου, το μόριο είναι υπό γωνία και έχει διαφορά ηλεκτραρνητικότητας με την έλξη του θείου να είναι μικρότερη από αυτή του οξυγόνου. Επομένως, υπάρχει μια μόνιμη διπολική στιγμή. Η διπολική ροπή είναι αποτέλεσμα της ανομοιόμορφης κατανομής αρνητικών και θετικών φορτίων.




