Διαφορά μεταξύ ουρανίου και θορίου
Κύρια διαφορά – Ουράνιο εναντίον Θόριο
Το ουράνιο και το θόριο είναι γνωστά ραδιενεργά στοιχεία που μπορούν να βρεθούν στη φύση σε σημαντικές ποσότητες. Ανήκουν στη σειρά ακτινιδών του μπλοκ f του περιοδικού πίνακα. Τόσο το ουράνιο όσο και το θόριο είναι ασθενώς ραδιενεργά στοιχεία και αποτελούνται από έναν αριθμό ραδιενεργών ισοτόπων. Δεδομένου ότι είναι ασθενώς ραδιενεργά, ορισμένα ισότοπα ουρανίου και θορίου έχουν διαφορετικές εφαρμογές. Αυτά τα χημικά στοιχεία μπορεί επίσης να είναι επικίνδυνα λόγω της ραδιενέργειας τους. Η κύρια διαφορά μεταξύ του Ουρανίου και του Θορίου είναι ότι το Ουράνιο έχει ένα φυσικό σχάσιμο ισότοπο ενώ το Θόριο δεν έχει σχάσιμα ισότοπα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Ουράνιο
– Ορισμός, Ραδιενέργεια, Ισότοπα, Εφαρμογές
2. Τι είναι το Thorium
– Ορισμός, Ραδιενέργεια, Ισότοπα, Εφαρμογές
3. Ποιες είναι οι ομοιότητες ανάμεσα στο Ουράνιο και το Θόριο
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά ανάμεσα στο Ουράνιο και το Θόριο
– Σύγκριση βασικών διαφορών
Βασικοί όροι:σχάσιμο υλικό, ισότοπο, ραδιενεργή διάσπαση, ραδιενέργεια, θόριο, ουράνιο
Τι είναι το Ουράνιο
Το ουράνιο είναι ένα ραδιενεργό χημικό στοιχείο που έχει τον ατομικό αριθμό 92 και το σύμβολο U . Το ουράνιο ανήκει στην ομάδα των ακτινιδών του περιοδικού πίνακα των στοιχείων. Βρίσκεται στο μπλοκ f του περιοδικού πίνακα. Το ατομικό βάρος του πιο σταθερού και άφθονου ισοτόπου του Ουρανίου είναι περίπου 238,02 amu. Η διαμόρφωση ηλεκτρονίων του Ουρανίου μπορεί να δοθεί ως [Rn]5f6d7s.
Σε θερμοκρασία και πίεση δωματίου, το ουράνιο είναι ένα στερεό μέταλλο. Το σημείο τήξης του ουρανίου είναι περίπου 1132C. Το σημείο βρασμού είναι περίπου 4130C. Το ουράνιο μπορεί να έχει μερικές σταθερές θετικές καταστάσεις οξείδωσης αφού το ουράνιο έχει 6 ηλεκτρόνια σθένους.
Υπάρχουν πολλά ισότοπα του Ουρανίου. Το πιο άφθονο ισότοπο είναι το Ουράνιο-238. (Η αφθονία είναι περίπου 99%). Το Uranium-235 και το Uranium-234 μπορούν επίσης να βρεθούν στη φύση. Υπάρχουν όμως σε ίχνη. Το ουράνιο-235 είναι πολύ σημαντικό μεταξύ αυτών των ισοτόπων, καθώς είναι το μόνο σχάσιμο ισότοπο που υπάρχει στη φύση. Έτσι, το ουράνιο χρησιμοποιείται ευρέως σε πυρηνικούς σταθμούς ηλεκτροπαραγωγής και πυρηνικά όπλα.

Εικόνα 1:Μοντέλο ατόμου ουρανίου 235
Το ουράνιο-238 ονομάζεται γόνιμο υλικό, καθώς αυτό το στοιχείο δεν είναι σχάσιμο αλλά μπορεί να μετατραπεί σε ισότοπο που μπορεί να διατηρήσει μια αλυσιδωτή αντίδραση με κάποια άλλη μέθοδο, όπως ο βομβαρδισμός με ένα νετρόνιο υψηλής ταχύτητας.
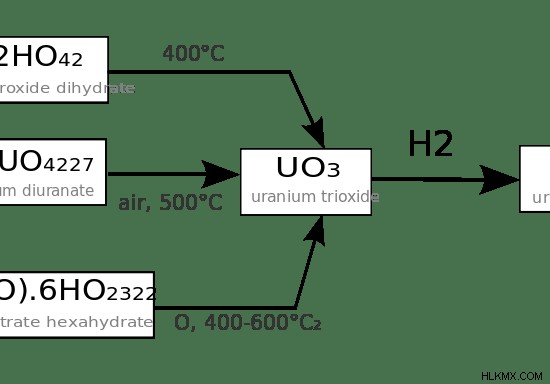
Εικόνα 2:Μερικές αντιδράσεις οξειδίων ουρανίου
Το στοιχείο ουρανίου μπορεί να σχηματίσει οξείδια. Τα άλατα του ουρανίου είναι υδατοδιαλυτά. Μπορούν να δώσουν διαφορετικά χρώματα σε υδατικά διαλύματα ανάλογα με τις καταστάσεις οξείδωσής τους. Επιπλέον, το ουράνιο μπορεί να σχηματίσει αλογονίδια όπως τα UF4 και UF6. Αυτά τα φθορίδια σχηματίζονται όταν το μέταλλο ουράνιο αντιδρά με HF (υδροφθόριο) ή F2 (Αέριο φθόριο).
Τι είναι το Thorium
Το θόριο είναι ένα ραδιενεργό χημικό στοιχείο που έχει τον ατομικό αριθμό 90 και το σύμβολο Th. Το θόριο ανήκει στη σειρά ακτινιδών του μπλοκ f στον περιοδικό πίνακα στοιχείων. Είναι σε στερεά κατάσταση σε θερμοκρασία και πίεση δωματίου. Η ηλεκτρονική διαμόρφωση του Thorium είναι [Rn]6d7s. Το ατομικό βάρος του πιο σταθερού και άφθονου ισοτόπου του Θορίου είναι περίπου 232.038 amu.
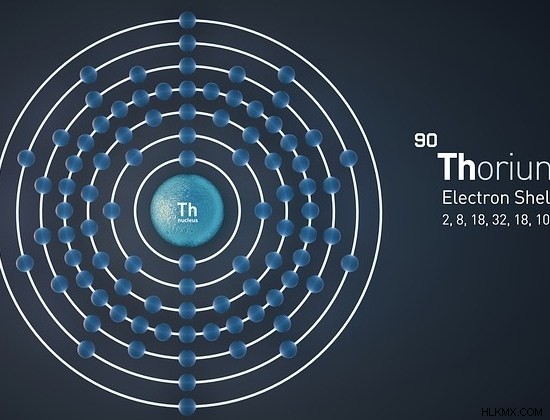
Εικόνα 3:Χημική δομή του ατόμου θορίου
Το σημείο τήξης του θορίου είναι περίπου 1750 C και το σημείο βρασμού είναι περίπου 4785 C. Η πιο κοινή κατάσταση οξείδωσης του Θορίου είναι το 4 αφού ο αριθμός των ηλεκτρονίων σθένους στο Θόριο είναι 4. Αλλά μπορεί να υπάρχουν και άλλες καταστάσεις οξείδωσης όπως +3, +2 και +1. Αυτές είναι αδύναμες βασικές ενώσεις.
Το Θόριο έχει μια σειρά από ισότοπα. Αλλά το πιο σταθερό και άφθονο ισότοπο είναι το Θόριο-232. (Η αφθονία είναι περίπου 99%). Άλλα ισότοπα βρίσκονται σε πολύ ίχνη. Το θόριο είναι εξαιρετικά αντιδραστικό και μπορεί να σχηματίσει διαφορετικές ενώσεις. Το θόριο μπορεί να εμπλέκεται στο σχηματισμό ανόργανων ενώσεων και ενώσεων συντονισμού.
Δεδομένου ότι το Θόριο είναι πιο άφθονο από το Ουράνιο, το Θόριο μπορεί να χρησιμοποιηθεί ως εναλλακτική λύση για το Ουράνιο σε πυρηνικούς σταθμούς ηλεκτροπαραγωγής. Ωστόσο, το Θόριο είναι επικίνδυνο λόγω της ραδιενέργειας του. Αλλά το Θόριο διασπάται αργά και τείνει να εκπέμπει ακτινοβολία άλφα. Επομένως, η έκθεση στο θόριο για σύντομο χρονικό διάστημα μπορεί να μην προκαλεί κανέναν κίνδυνο (επειδή η ακτινοβολία άλφα δεν μπορεί να διεισδύσει στο δέρμα μας).
Ομοιότητες μεταξύ ουρανίου και θορίου
- Το ουράνιο και το θόριο είναι ραδιενεργά στοιχεία.
- Και τα δύο στοιχεία υφίστανται αργή αποσύνθεση άλφα.
- Και τα δύο στοιχεία βρίσκονται στη σειρά ακτινιδών του μπλοκ f του περιοδικού πίνακα στοιχείων.
- Και τα δύο στοιχεία έχουν φυσικά ισότοπα.
- Και τα δύο χημικά στοιχεία χρησιμοποιούνται σε πυρηνικούς σταθμούς ηλεκτροπαραγωγής και πυρηνικά όπλα.
Διαφορά μεταξύ ουρανίου και θορίου
Ορισμός
Ουράνιο: Το ουράνιο είναι ένα ραδιενεργό χημικό στοιχείο που έχει τον ατομικό αριθμό 92 και το σύμβολο U.
Θόριο: Το θόριο είναι ένα ραδιενεργό χημικό στοιχείο που έχει ατομικό αριθμό 90 και το σύμβολο Th.
Σημείο τήξης και σημείο βρασμού
Ουράνιο: Το σημείο τήξης του ουρανίου είναι περίπου 1132C. Το σημείο βρασμού είναι περίπου 4130C.
Θόριο: Το σημείο τήξης του Θορίου είναι περίπου 1750C. Το σημείο βρασμού είναι περίπου 4785 C.
Ισότοπα
Ουράνιο: Το ουράνιο έχει πολλά ισότοπα, συμπεριλαμβανομένου ενός φυσικού σχάσιμου ισοτόπου.
Θόριο: Το θόριο έχει πολλά ισότοπα, αλλά δεν υπάρχουν φυσικά σχάσιμα ισότοπα.
Αριθμός ηλεκτρονίων σθένους
Ουράνιο: Το ουράνιο έχει 6 ηλεκτρόνια σθένους.
Θόριο: Το θόριο έχει 4 ηλεκτρόνια σθένους.
Αφθονία
Ουράνιο: Το ουράνιο είναι λιγότερο άφθονο από το Θόριο.
Θόριο: Το θόριο είναι πιο άφθονο από το Ουράνιο.
Συμπέρασμα
Το ουράνιο και το θόριο είναι δύο από τα τρία στοιχεία που μπορούν να υποστούν σημαντικά ραδιενεργό διάσπαση και βρίσκονται σε μεγάλες ποσότητες στη φύση συγκριτικά. Ωστόσο, αυτά είναι επικίνδυνα στοιχεία που μπορούν να προκαλέσουν διάφορες ασθένειες στον οργανισμό μας λόγω της ραδιενέργειας τους. Ωστόσο, η έκθεση σε μικρή ποσότητα για πολύ σύντομο χρονικό διάστημα μπορεί να μην είναι τόσο επιβλαβής, καθώς αυτά τα στοιχεία τείνουν να υφίστανται αποσύνθεση άλφα και η αποσύνθεση εμφανίζεται πολύ αργά.




